
【题目】(1)实验室用锌片和稀硫酸反应制取氢气,并验证氢气的还原性及回收硫酸锌晶体。
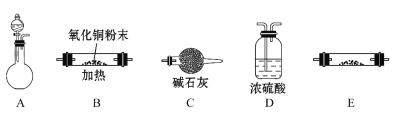
①各仪器的连接顺序为________________,装置C的作用是_________________。
②锌与硫酸反应制取氢气后的剩余废液中,常含有少量剩余的硫酸,欲除去多余的硫酸并回收硫酸锌晶体,请从BaCl2溶液、锌粉、NaOH溶液三种试剂中选用一种试剂除杂并简述回收硫酸锌晶体的实验过程______________________。
(2)工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4·7H2O的流程如下。
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为3.7、6.5、9.7。
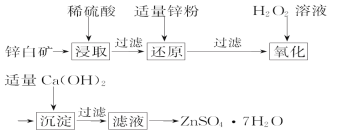
①为了提高酸浸效率,可以采取的措施有_____________、 (写出两条即可)。
②氧化过程中H2O2发生反应的离子方程式为___________________________。
③由滤液得到ZnSO4·7H2O的操作依次为__________、___________、过滤、洗涤、干燥。
【答案】
(1)①ADBEC;防止空气中的水进入装置,干扰H2氧化产物的检验②向废液中加入足量的锌粉,充分反应后过滤,将滤液蒸发浓缩、冷却结晶,即可得到较纯净的硫酸锌晶体
(2)①将矿石粉碎;提高浸取温度;适当增加硫酸的浓度(合理即可)
②H2O2+2Fe2++2H+=2Fe3++2H2O
③蒸发浓缩,冷却结晶
【解析】
试题分析:(1)①装置A中锌片与稀硫酸反应产生H2,然后将H2通过装置D进行干燥,再通过装置B与CuO反应,然后通过装有无水CuSO4粉末的装置E,检验生成的水,最后接装置C,防止空气中的水蒸气进入装置E,故答案为:ADBEC;防止空气中的水进入装置,干扰H2氧化产物的检验;
②向废液中加入足量锌粉除去剩余的硫酸,过滤除去多余的锌,将滤液蒸发浓缩、冷却结晶,即可得到硫酸锌晶体,故答案为:向废液中加入足量的锌粉,充分反应后过滤,将滤液蒸发浓缩、冷却结晶,即可得到较纯净的硫酸锌晶体;
(2)①根据影响化学反应速率的因素,将矿石粉碎,适当增大硫酸浓度、加热升高温度、边加硫酸边搅拌或增加浸出时间等,都可以提高酸浸效率,故答案为:将矿石粉碎;提高浸取温度;适当增加硫酸的浓度;
②加入双氧水的目的是将Fe2+氧化为Fe3+,根据得失电子守恒、电荷守恒配平离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O,故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;
③由滤液得到晶体的实验操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:蒸发浓缩,冷却结晶。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),最高价氧化物对应水化物具有两性的是____________,最高价氧化物对应水化物中酸性最强的是__________。
(2)⑥的单质在氯气中燃烧产物的电子式: 。
(3)写出⑦的单质和NaOH溶液反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4LCHCl3中含有氯原子数目为3NA
B.常温常压下,2gD216O中含中子数、质子数、电子数均为NA
C.常温下,0.1mol/LNa2CO3溶液中,含有阴离子的总数小于0.1NA
D.同温、同压下,相同体积的氯气和氩气所含的原子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表的一部分,根据元素①~⑧在周期表中的位置,按要求回答下列问题。
族 | IA | 0族 | ||||||
1 | ① | IIA | IIIA | ⅣA | VA | ⅥA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
(1)在元素①~⑧中,金属性最强的元素是_____________(填元素符号),最不容易形成化合物的元素是______________(填元素符号)。
(2)用电子式表示⑦的气态氢化物的形成过程__________________________________。
(3)③、④、⑥中原子半径由大到小的顺序是____________________(填元素符号)。
(4)表中两种元素的原子按1:1组成的常见液态化合物X易被催化分解。某同学取5支大小相同的试管,各加入等物质的量浓度等体积的X溶液,分别进行下列实验,研究外界条件对X分解反应速率的影响,实验记录如下表所示。
序号 | 条件 | 现象 | 结论 | ||
温度/℃ | 催化剂 | ||||
第一组 | 1 | 40 | FeCl3溶液 | 快速产生大量气泡 | 相同条件下,温度升高,化学反应速率加快 |
2 | 20 | A | 缓慢产生适量气泡 | ||
3 | 5 | FeCl3溶液 | 缓慢产生极少量气泡 | ||
第二组 | 4 | t | MnO2 | 快速产生大量气泡 | |
5 | 20 | 无 | 缓慢产生极少量气泡 | ||
①第一组实验目的是:相同条件下,探究________________对该反应速率的影响。
实验2的催化剂A是___________________。
②第二组实验中,实验4的温度t是_________________,发生反应的化学方程式是__________________。
第二组实验结论是:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钾和金属钠的金属性相近,但K比Na略强,当利用金属钠与KCl共熔制金属钾时,发现钾与钠的共熔体难以分离,如调整温度到一定程度,则可利用钠与KCl反应制取K,下面是四种物质的熔沸点:
K | Na | KCl | NaCl | |
熔点(℃) | 63.6 | 97.8 | 770 | 801 |
沸点(℃) | 774 | 882.9 | 1500 | 1413 |
根据平衡移动原理,可推知用Na与KCl反应制取金属钾的适宜温度是
A.850℃ B.高于882.9℃
C.低于770℃ D.1413~1500℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,两种酸的电离常数如下表。
Ka1 | Ka2 | |
H2A | 1.3×10-2 | 6.3×10-6 |
H2B | 4.2×10-7 | 5.6×10-7 |
下列叙述中正确的是
A.H2A的电离方程式:H2A=2H++A2-
B.常温下,在水中Na2B的水解平衡常数为:![]()
C.等浓度的Na2A和Na2B溶液,由水电离产生的H+浓度大小关系为:前者大于后者
D.向Na2B溶液中加入少量H2A溶液,可发生反应:B2-+H2A=A2-+H2B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com