
【题目】制备硅单质时,主要化学反应如下:
(1)SiO2+2C![]() Si+2CO↑
Si+2CO↑
(2)Si+2Cl2![]() SiCl4
SiCl4
(3)SiCl4+2H2![]() Si+4HCl
Si+4HCl
下列对上述三个反应的叙述中,不正确的是( )
A. (1)(3)为置换反应 B. (1)(2)(3)均为氧化还原反应
C. (2)为化合反应 D. 三个反应的反应物中硅元素均被还原
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】观察下列模型并结合有关信息,判断有关说法正确的是( )
B12结构单元 | SF6分子 | S8 | HCN | |
结构模 型示意 图 |
|
|
|
|
备注 | 熔点1873K | — | 易溶于CS2 | — |
A. 单质硼属于原子晶体 B. SF6是由极性键构成的极性分子
C. 固态硫S8属于原子晶体 D. HCN的结构式为HC=N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | K=1.77×10-4 | K=5.0×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
下列叙述错误的是
A. NaCN溶液中通人少量CO2发生的离子反应为:CN-+H2O+CO2=HCN+HCO3-
B. 等体积、等物质的量浓度的HCOONa和NaCN溶液中所含阴离子总数前者大于后者
C. 等物质的量浓度的NaHCO3和Na2CO3混合溶液中:c(Na+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+)
D. 中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氨酯类高分子材料PU用途广泛,其合成反应为:
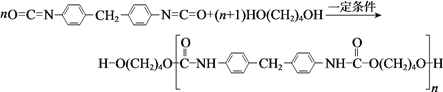
下列说法不正确的是
A. HO(CH2)4OH的沸点高于CH3CH2CH2CH3
B. 高分子材料PU在强酸、强碱中能稳定存在
C. 合成PU的两种单体的核磁共振氢谱中均有3个吸收峰
D. 以1,3-丁二烯为原料,可合成HO(CH2)4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配平该方程式__KMnO4+__HCl (浓) =__KCl+__MnCl2+__Cl2↑+__H2O
(2)反应中(1)中____是还原剂,_____是还原产物 .
(3)该反应的离子方程式为:_______________________
(4)用双线桥法分析此氧化还原反应____________________________
(5)NA表示阿伏伽德罗常数,若产生标准状况下的气体的体积为2.24L ,则反应过程中转移电子的数目为_________,被氧化的HCl的质量为_____g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%。有效“减碳”的手段之一是节能。
I.下列制氢方法最节能的是______(填字母序号)。
A.电解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O![]() CO+3H2
CO+3H2
II.科学家提出“绿色自由”构想,把空气中的CO2使用合适的催化剂可转化为可再生能源甲醇(CH3OH)。该反应的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
(1)若在一个定温定容的容器中发生上述反应,反应达到平衡的标志是______ (填字母序号)。
A.CO2和CH3OH的浓度相等 B.3v正(H2)=v逆(H2O)
C.容器内压强保持不变 D.H2的百分含量保持不变
E. 容器中混合气体的密度保持不变
(2)若将CO2和H2的混合气体分成五等份,将它们分别充入温度不同、容积相同的恒容容器中发生上述反应。反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如右图,则上述CO2转化为甲醇的反应的△H______0(填“>”、“<”或“=”)。

(3) 300℃时,将CO2和H2按1:3的体积比充入某密闭容器中,CO2的平衡转化率(α)与体系总压强(P)的关系如右图所示。回答问题:

①若其他条件不变,将A点的体积压缩至原来的一半,一段时间后反应再次达到平衡,与原平衡相比较下列说法正确的是_______(填字母序号)。
A.CO2的浓度减小 B.正反应速率增大,逆反应速率增大
C.甲醇的物质的量增加 D.重新平衡时n(H2)/n(CH3OH)增大
②B点平衡混合气体的平均摩尔质量为________(保留一位小数)。
(4)甲醇—空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理示意图如图,该燃料电池的电池反应式为2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l),则负极的电极反应式为____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)现有下列物质;①熔融的NaCl ②液态HCl ③蔗糖 ④汞 ⑤NaOH溶液 ⑥稀硫酸 ⑦CO2 ⑧KCl晶体
其中属于电解质的是__________;属于非电解质的是__________;能导电的有__________。
(2)按要求填空。
①NaHSO4溶液(写出电离方程式)____________________________。
②苏打和澄清石灰水反应(写出离子方程式)_______________________________
(3)配平下列氧化还原方程式:
①_____Fe+_____HNO3 = _____Fe(NO3)3+_____NO↑+_____H2O
②____CO+____ Fe2O3 ![]() ____Fe+_____CO2
____Fe+_____CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列常见物质的俗名或主要成份与化学式相对应的是( )
A.苏打——NaHCO3B.生石灰 Ca(OH)2
C.漂白粉——Ca(ClO)2和CaCl2D.纯碱——NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项括号内为杂质,后面为除杂质操作,其中正确的是( )
A.乙酸乙酯(乙酸),加NaOH溶液、分液
B.福尔马林(乙酸),加Na2CO3溶液、分液
C.溴乙烷(乙醇),加水振荡、分液
D.苯(苯酚),加溴水振荡、过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com