
【题目】25℃时,向H2CO3溶液中滴入NaOH溶液,溶液中H2CO3、HCO3-及CO32-的物质的量分数δ(X)随溶液pH的变化如图所示[δ(X)=[![]() ]×100%]。
]×100%]。
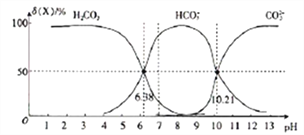
下列说法错误的是( )
A. H2CO3的一级电离平衡常数的对数值lgK1(H2CO3)=-6.38
B. pH=7时,c(HCO3-)>c(H2CO3)> c(CO32-)
C. pH=13时,c(Na+)+c(H+)=c(OH-)+2c(CO32-)
D. 25℃时,反应CO32-+H2O![]() HCO3-+OH-的平衡常数对数值1gK=-3.79
HCO3-+OH-的平衡常数对数值1gK=-3.79
【答案】C
【解析】根据图像可知,pH=6.38时,c(H+)=10-6.38mol/L,c(H2CO3)= c(HCO3-) ,所以,H2CO3的一级电离平衡常数的对数值lgK1(H2CO3)=-6.38,A项正确;由图中信息可知,pH=7时,c(HCO3-)>c(H2CO3)> c(CO32-),B项正确;pH=13时,由电荷守恒可知,c(Na+)十c(H+)=c(OH-)+ c(HCO3-)+2c(CO32-),C项错误;由图可知,pH=10.21时,c(H+)=10-10.21mol/L,c(CO32-)= c(HCO3-) ,所以K2(H2CO3)= 10-10.21,因此,25℃时,反应CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=
HCO3-+OH-的平衡常数Kh=![]() =10-3.79,其对数值1gK=-3.79,D项正确。
=10-3.79,其对数值1gK=-3.79,D项正确。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池工作原理如图所示。在电解质溶液中发生的电池总反应为:VO2+(蓝色)+H2O+V3+(紫色)![]() VO2+(黄色)+V2+(绿色)+2H+。下列说法正确的是( )
VO2+(黄色)+V2+(绿色)+2H+。下列说法正确的是( )

A. 当电池无法放电时,只要更换电解质溶液,不用外接电源进行充电就可正常工作
B. 放电时,负极反应为VO2++2H++e-=VO2++H2O
C. 放电时,正极附近溶液由紫色变绿色
D. 放电过程中,正极附近溶液的pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表和元素周期律的说法正确的是
A. Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B. 第二周期元素从Li到F,非金属性逐渐增强
C. 因为Na比K容易失去电子,所以Na比K的还原性强
D. O与S为同主族元素,且O比S的非金属性弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的是
A. 1 mol羟基中含有l0NA个电子
B. 常温下,22.4 L CH4在O2中完全燃烧,生成NA个CO2分子
C. 标准状况下,18 g H2O中所含的氧原子数为NA
D. 0.2 mol L-1的NH4Cl溶液中含有0.2NA个NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题.
(1)①已知C(s)+H2O(g)═CO(g)+H2(g)△H1=+131.3kJmol﹣1
C(s)+2H2O(g)═CO2(g)+2H2(g)△H2=+90kJmol﹣1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 .
(2)将燃烧废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
①该反应平衡常数表达式为K= .
②若温度不变,减小反应投料比[ ![]() ],则K将(填“增大”“减小”或“不变”).
],则K将(填“增大”“减小”或“不变”).
(3)通过水煤气合成二甲醚的热化学方程式如下:
3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g)△H=﹣aKJ/mol
该反应在一定条件下的密闭容器中可达到平衡状态(曲线1),若在t0时刻改变一个条件,曲线I变为曲线Ⅱ,改变的条件是 . (填字母编号)
A.升高温度
B.加入催化剂
C.缩小容器体积
D.增加H2的浓度
E.分离出二甲醚.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业合成氨的原理是:N2(g)+3H2(g)2NH3(g)△H=﹣93.0kJ/mol;
另据报道,一定条件下:2N2(g)+6H2O(l)4NH3(g)+3O2(g)△H=+1530.0kJ/mol.
(1)氢气的燃烧热△H=kJ/mol.
(2)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是 .
A.气体体积不再变化,则已平衡
B.气体密度不再变化,尚未平衡
C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动
D.平衡后,压缩装置,生成更多NH3
(3)在恒温恒容装置中进行合成氨反应.
①表示N2浓度变化的曲线是 .
②前25min 内,用H2浓度变化表示的化学反应速率是 .
③在25min末刚好平衡,则平衡常数K= .
(4)在第25min 末,保持其它条件不变,升高温度,在第35min末再次平衡.平衡移动过程中H2浓度变化了1.5molL﹣1 , 在图中画出第25min~40min NH3浓度变化曲线 . 
(5)已知常温下,NH4+的水解常数为1.0×10﹣9 , 则0.1mol/L NH4Cl溶液pH= . (忽略NH4+水解对NH4+浓度的影响)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应属于加成反应的是( )
A.CH4+Cl2 ![]() CH3Cl+HCl
CH3Cl+HCl
B.CH2═CH2+Br2→CH2BrCH2Br
C.2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.![]() +HNO3
+HNO3 ![]()
![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C.78g苯中含有的碳碳双键数目为3NA
D.1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com