
【题目】为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题.
(1)①已知C(s)+H2O(g)═CO(g)+H2(g)△H1=+131.3kJmol﹣1
C(s)+2H2O(g)═CO2(g)+2H2(g)△H2=+90kJmol﹣1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 .
(2)将燃烧废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
①该反应平衡常数表达式为K= .
②若温度不变,减小反应投料比[ ![]() ],则K将(填“增大”“减小”或“不变”).
],则K将(填“增大”“减小”或“不变”).
(3)通过水煤气合成二甲醚的热化学方程式如下:
3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g)△H=﹣aKJ/mol
该反应在一定条件下的密闭容器中可达到平衡状态(曲线1),若在t0时刻改变一个条件,曲线I变为曲线Ⅱ,改变的条件是 . (填字母编号)
A.升高温度
B.加入催化剂
C.缩小容器体积
D.增加H2的浓度
E.分离出二甲醚.
【答案】
(1)CO(g)+H2O(g)═CO2(g)+H2(g)△H=+41kJ/mol
(2)![]() ,不变
,不变
(3)C,D
【解析】解:(1)①已知C(s)+H2O(g)═CO(g)+H2(g)△H1=+131.3kJmol﹣1
C(s)+2H2O(g)═CO2(g)+2H2(g)△H2=+90kJmol﹣1
由盖斯定律可知,①﹣②得到CO(g)+H2O(g)═CO2(g)+H2(g)△H=(+131.3kJmol﹣1)﹣(+90kJmol﹣1)=+41kJ/mol,
即热化学方程式为CO(g)+H2O(g)═CO2(g)+H2(g)△H=+41kJ/mol,
所以答案是:CO(g)+H2O(g)═CO2(g)+H2(g)△H=+41kJ/mol;
(2)①K为生成物浓度幂之积与反应物浓度幂之积的比,由反应可知K= ![]() ,所以答案是:
,所以答案是: ![]() ;
;
②K只与温度有关,若温度不变,减小反应投料比[ ![]() ],则K将不变,
],则K将不变,
所以答案是:不变;
(3)在t0时刻改变一个条件,曲线I变为曲线Ⅱ,达到平衡的时间减少,CO的转化率增大,则
A.升高温度,速率加快,为放热反应,则平衡逆向移动,CO转化率减小,故A不选;
B.加入催化剂,平衡不移动,故B不选;
C.缩小容器体积,反应速率加快,该反应为气体体积减小的反应,则平衡正向移动,CO转化率增大,故C选;
D.增加H2的浓度,反应速率加快,平衡正向移动,CO转化率增大,故D选;
E.分离出二甲醚,平衡正向移动,CO转化率增大,但反应速率减小,故E不选;
所以答案是:CD.
【考点精析】认真审题,首先需要了解化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%).


科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O2(g)═CO2(g);△H1 C(s)+ ![]() O2(g)═CO(g);△H2
O2(g)═CO(g);△H2
②S(s)+O2(g)═SO2(g);△H3 S(g)+O2(g)═SO2(g);△H4
③H2(g)+ ![]() O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
④CaCO3(s)═CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)═Ca(OH)2(s);△H8 .
A.①
B.④
C.②③④
D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或说法正确的是( )
A. 甲烷的燃烧热为ΔH=-890 kJ·mol-1 ,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890 kJ· mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. 已知:H2(g)+F2(g)=2HF(g) ΔH=-270 kJ·mol-1 ,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
D. 在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向H2CO3溶液中滴入NaOH溶液,溶液中H2CO3、HCO3-及CO32-的物质的量分数δ(X)随溶液pH的变化如图所示[δ(X)=[![]() ]×100%]。
]×100%]。
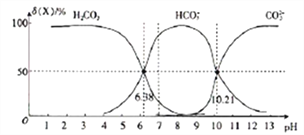
下列说法错误的是( )
A. H2CO3的一级电离平衡常数的对数值lgK1(H2CO3)=-6.38
B. pH=7时,c(HCO3-)>c(H2CO3)> c(CO32-)
C. pH=13时,c(Na+)+c(H+)=c(OH-)+2c(CO32-)
D. 25℃时,反应CO32-+H2O![]() HCO3-+OH-的平衡常数对数值1gK=-3.79
HCO3-+OH-的平衡常数对数值1gK=-3.79
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以有机物A为原料可以合成药物SERMs的中间体E。其合成路线如下:

回答下列问题:
(1)A的化学名称为_________;E中官能团的名称为________________。
(2)A~B的反应类型为________,B→C的反应类型为________________。
(3)B的结构简式为_________________。
(4)由D生成E的化学方程式为__________________。
(5)二取代芳香族化合物W是E的同分异构体,符合下列条件的W共有___种(不含立体异构)。
①1molW能与足量银氨溶液发生银镜反应生成4molAg
②能与FeCl3溶液发生显色反应
其中核磁共振氢谱为六组峰的结构简式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol·L-1的某二元酸H2A溶液中,可能存在的含A粒子(H2A、HA-、A2-)的物质的量分数随pH变化的关系如图所示,下列说法正确的是( )

A. H2A的电离方程式:H2A![]() H++HA-
H++HA-
B. pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100
C. 等物质的量浓度的NaHA和Na2A溶液等体积混合, 离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)
D. Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+ 2c(H2A),各粒子浓度均大于0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 是短周期元素,其在周期表的位置如图,请找出错误选项( )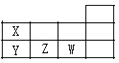
A.原子半径:Y>Z>W
B.酸性:HWO4>HXO3>H3YO4
C.热稳定性:HW>XH3>YH3
D.离子半径:Y3﹣<Z2﹣<W﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com