
【题目】加入氢氧化钾溶液之后,溶液中下列离子数目明显减少的是( )
A.硝酸根离子B.钠离子C.钡离子D.铜离子
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.共价化合物中一定不含离子键
B.离子化合物中一定不含共价键
C.任何化学物质中均存在化学键
D.全部由非金属元素形成的化合物一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表和元素周期律的说法正确的是
A. Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B. 第二周期元素从Li到F,非金属性逐渐增强
C. 因为Na比K容易失去电子,所以Na比K的还原性强
D. O与S为同主族元素,且O比S的非金属性弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题.
(1)①已知C(s)+H2O(g)═CO(g)+H2(g)△H1=+131.3kJmol﹣1
C(s)+2H2O(g)═CO2(g)+2H2(g)△H2=+90kJmol﹣1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 .
(2)将燃烧废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
①该反应平衡常数表达式为K= .
②若温度不变,减小反应投料比[ ![]() ],则K将(填“增大”“减小”或“不变”).
],则K将(填“增大”“减小”或“不变”).
(3)通过水煤气合成二甲醚的热化学方程式如下:
3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g)△H=﹣aKJ/mol
该反应在一定条件下的密闭容器中可达到平衡状态(曲线1),若在t0时刻改变一个条件,曲线I变为曲线Ⅱ,改变的条件是 . (填字母编号)
A.升高温度
B.加入催化剂
C.缩小容器体积
D.增加H2的浓度
E.分离出二甲醚.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业合成氨的原理是:N2(g)+3H2(g)2NH3(g)△H=﹣93.0kJ/mol;
另据报道,一定条件下:2N2(g)+6H2O(l)4NH3(g)+3O2(g)△H=+1530.0kJ/mol.
(1)氢气的燃烧热△H=kJ/mol.
(2)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是 .
A.气体体积不再变化,则已平衡
B.气体密度不再变化,尚未平衡
C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动
D.平衡后,压缩装置,生成更多NH3
(3)在恒温恒容装置中进行合成氨反应.
①表示N2浓度变化的曲线是 .
②前25min 内,用H2浓度变化表示的化学反应速率是 .
③在25min末刚好平衡,则平衡常数K= .
(4)在第25min 末,保持其它条件不变,升高温度,在第35min末再次平衡.平衡移动过程中H2浓度变化了1.5molL﹣1 , 在图中画出第25min~40min NH3浓度变化曲线 . 
(5)已知常温下,NH4+的水解常数为1.0×10﹣9 , 则0.1mol/L NH4Cl溶液pH= . (忽略NH4+水解对NH4+浓度的影响)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2+3H2![]() 2NH3,是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是
2NH3,是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是
A. 达到平衡时,反应速率:v(正)=v(逆)=0
B. 恒温恒压下,充入少量He,反应速率减慢
C. 升温正反应速率加快,逆反应速率减慢
D. 若在反应的密闭容器加入1 mol N2和过量的H2,最后能生成2 mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应属于加成反应的是( )
A.CH4+Cl2 ![]() CH3Cl+HCl
CH3Cl+HCl
B.CH2═CH2+Br2→CH2BrCH2Br
C.2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.![]() +HNO3
+HNO3 ![]()
![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气部分氧化制取的化工原料气中,常含有氧硫化碳(COS,结构类似于CO2),目前氧硫化碳脱除可采用氢解和水解两种方法,其反应原理如下:
氢解:COS(g)+H2(g)![]() H2S(g)+CO(g)
H2S(g)+CO(g)
水解:COS(g)+H2O(g)![]() H2S(g)+CO2(g)
H2S(g)+CO2(g)
(1)氧硫化碳的电子式为________________________________。
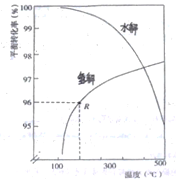
(2)如下图是氧硫化碳水解和氢解平衡转化率随温度变化曲线。
①观察图像,水解与氢解相比优势为_________________________________。
②水解的△H___0(填“大于"或“小于”)
③已知:1molCOS(g)完全氢解能量变化为6.99kJ,若初始COS的物质的量为nmol,从反应开始到R点所示体系的能量变化为______kJ(只列式,不必计算)。
(3)氢解和水解产生的H2S必须进行回收处理,酸性、可溶性铁盐氧化H2S制取硫磺工艺备受重视。
①写出酸性条件下用氢氧化铁溶液吸收H2S制取硫磺的离子方程式___________________________。
②吸收H2S后的酸性废液中的Fe2+,可通过电解法使Fe3+再生,写出电解时总反应的离子方程式:__________。
③常温下,在c(H+)=0.30mo/L的酸性溶液中通入H2S至饱和,测得硫化氢的平衡浓度为0.10mol/L,计算此时溶液中c(S2-)=_______[忽略H2S电离生成的H+,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.0×10-15,结果保留两位有效数字。]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来连续出现的铊中毒事件,给各科研单位及学校危险药品的管理敲响了警钟。铊的相关信息卡片如图所示:

(1)铊的原子序数为81,铊在元素周期表中位于第________周期第________族。
(2)若设铊的质量数为A,则铊原子中中子数和质子数之差为____________。
(3)下列推断正确的是________。
A.单质的还原性:Tl>Al B.原子半径:Al>Tl
C.碱性:Al(OH)3>Tl(OH)3 D.氧化性:Tl3+>Al3+
(4)铊(Tl)是某超导材料的组成元素之一。Tl3+与Ag在酸性介质中发生反应:
Tl3++2Ag===Tl++2Ag+。下列推断正确的是________。
A.Tl+最外层有1个电子 B.Tl能形成+3价和+1价的化合物
C.Tl3+的氧化性比Ag+弱 D.Tl+的还原性比Ag强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com