
【题目】天然气部分氧化制取的化工原料气中,常含有氧硫化碳(COS,结构类似于CO2),目前氧硫化碳脱除可采用氢解和水解两种方法,其反应原理如下:
氢解:COS(g)+H2(g)![]() H2S(g)+CO(g)
H2S(g)+CO(g)
水解:COS(g)+H2O(g)![]() H2S(g)+CO2(g)
H2S(g)+CO2(g)
(1)氧硫化碳的电子式为________________________________。
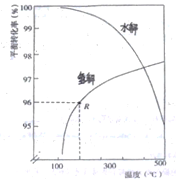
(2)如下图是氧硫化碳水解和氢解平衡转化率随温度变化曲线。
①观察图像,水解与氢解相比优势为_________________________________。
②水解的△H___0(填“大于"或“小于”)
③已知:1molCOS(g)完全氢解能量变化为6.99kJ,若初始COS的物质的量为nmol,从反应开始到R点所示体系的能量变化为______kJ(只列式,不必计算)。
(3)氢解和水解产生的H2S必须进行回收处理,酸性、可溶性铁盐氧化H2S制取硫磺工艺备受重视。
①写出酸性条件下用氢氧化铁溶液吸收H2S制取硫磺的离子方程式___________________________。
②吸收H2S后的酸性废液中的Fe2+,可通过电解法使Fe3+再生,写出电解时总反应的离子方程式:__________。
③常温下,在c(H+)=0.30mo/L的酸性溶液中通入H2S至饱和,测得硫化氢的平衡浓度为0.10mol/L,计算此时溶液中c(S2-)=_______[忽略H2S电离生成的H+,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.0×10-15,结果保留两位有效数字。]
【答案】 ![]() 水解利用廉价水蒸气作转化剂,比氢气便宜、易得(或水解在较低温度下,氧硫化碳具有较高的转化率,比氢解节约能源) 小于 96%n×6.99 2Fe3++H2S=2Fe2++2H++S Fe2++2H+
水解利用廉价水蒸气作转化剂,比氢气便宜、易得(或水解在较低温度下,氧硫化碳具有较高的转化率,比氢解节约能源) 小于 96%n×6.99 2Fe3++H2S=2Fe2++2H++S Fe2++2H+![]() 2Fe3++H2↑ 1.0×10-21mol/L
2Fe3++H2↑ 1.0×10-21mol/L
【解析】(1)氧硫化碳的电子式为![]() ;(2)①观察图像,根据氧硫化碳水解和氢解平衡转化率随温度变化曲线可知,水解与氢解相比优势为:水解利用廉价水蒸气作转化剂,比氢气便宜、易得(或水解在较低温度下,氧硫化碳具有较高的转化率,比氢解节约能源);②根据曲线变化可知,升高温度,水解的平衡转化率降低,平衡逆向移动,逆反应为吸热,正反应为放热,△H小于0;③已知:1molCOS(g)完全氢解能量变化为6.99kJ,若初始COS的物质的量为nmol,从反应开始到R点(转化率为96%)所示体系的能量变化为96%×nmol×6.99kJ =96%n×6.99kJ;(3)①酸性条件下用氢氧化铁溶液吸收H2S制取硫磺,同时产生Fe2+,反应的离子方程式2Fe3++H2S=2Fe2++2H++S;②吸收H2S后的酸性废液中的Fe2+,可通过电解法使Fe3+再生,电解时Fe2+失电子产生Fe3+,H+得电子产生H2,故总反应的离子方程式:Fe2++2H+
;(2)①观察图像,根据氧硫化碳水解和氢解平衡转化率随温度变化曲线可知,水解与氢解相比优势为:水解利用廉价水蒸气作转化剂,比氢气便宜、易得(或水解在较低温度下,氧硫化碳具有较高的转化率,比氢解节约能源);②根据曲线变化可知,升高温度,水解的平衡转化率降低,平衡逆向移动,逆反应为吸热,正反应为放热,△H小于0;③已知:1molCOS(g)完全氢解能量变化为6.99kJ,若初始COS的物质的量为nmol,从反应开始到R点(转化率为96%)所示体系的能量变化为96%×nmol×6.99kJ =96%n×6.99kJ;(3)①酸性条件下用氢氧化铁溶液吸收H2S制取硫磺,同时产生Fe2+,反应的离子方程式2Fe3++H2S=2Fe2++2H++S;②吸收H2S后的酸性废液中的Fe2+,可通过电解法使Fe3+再生,电解时Fe2+失电子产生Fe3+,H+得电子产生H2,故总反应的离子方程式:Fe2++2H+![]() 2Fe3++H2↑;
2Fe3++H2↑;
③ H2S ![]() H+ + HS-
H+ + HS-
0.1mol/L 0.30ml/L c(HS-)
则Ka1(H2S)= 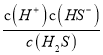 =
=![]() =1.3×10-7,解得c(HS-)=4.3×10-8mol/L;
=1.3×10-7,解得c(HS-)=4.3×10-8mol/L;
HS- ![]() H+ + S2-
H+ + S2-
4.3×10-8mol/L 0.30ml/L c(S2-)
则Ka2(H2S)= 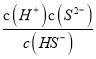 =
=![]() =7.0×10-15,解得c(S2-)=1.0×10-21mol/L。
=7.0×10-15,解得c(S2-)=1.0×10-21mol/L。


科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O2(g)═CO2(g);△H1 C(s)+ ![]() O2(g)═CO(g);△H2
O2(g)═CO(g);△H2
②S(s)+O2(g)═SO2(g);△H3 S(g)+O2(g)═SO2(g);△H4
③H2(g)+ ![]() O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
④CaCO3(s)═CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)═Ca(OH)2(s);△H8 .
A.①
B.④
C.②③④
D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol·L-1的某二元酸H2A溶液中,可能存在的含A粒子(H2A、HA-、A2-)的物质的量分数随pH变化的关系如图所示,下列说法正确的是( )

A. H2A的电离方程式:H2A![]() H++HA-
H++HA-
B. pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100
C. 等物质的量浓度的NaHA和Na2A溶液等体积混合, 离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)
D. Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+ 2c(H2A),各粒子浓度均大于0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的原子结构决定其性质和周期表中的位置.下列说法正确的是( )
A.元素原子的最外层电子数等于元素的最高化合价
B.多电子原子中,在离核较近的区域内运动的电子的能量较高
C.P,S,Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强
D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.乙烯能与溴的四氯化碳溶液反应使溶液逐渐褪色
B.乙醛能与新制氢氧化铜反应产生砖红色沉淀
C.糖类物质都能发生水解反应
D.在一定条件下,氨基酸之间能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 是短周期元素,其在周期表的位置如图,请找出错误选项( )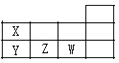
A.原子半径:Y>Z>W
B.酸性:HWO4>HXO3>H3YO4
C.热稳定性:HW>XH3>YH3
D.离子半径:Y3﹣<Z2﹣<W﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
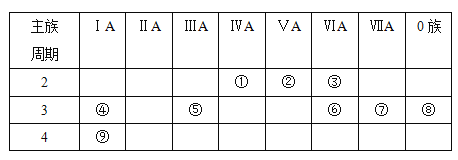
(1)在这些元素中,化学性质最不活泼的是________(填元素符号,下同)。
(2)从①到③的元素中,非金属性最强的是________
(3)在最高价氧化物的水化物中,酸性最强的化合物的化学式是_______,碱性最强的化合物的电子式是_________。
(4)最高价氧化物是两性氧化物的元素是_______;写出它的最高价氧化物与氢氧化钠反应的离子方程式_______________________________。
(5)用结构式表示元素①与③形成的一种可溶于水的化合物_________ 。
(6)写出元素④的单质与水反应的化学方程式________________________________。
(7)写出元素①的单质和元素⑥最高价氧化物对应水化物的浓溶液反应的化学方程式___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com