
| A. | Al(OH)3溶于稀H2SO4中:OH-+H+═H2O | |
| B. | 氨水滴入Al(Cl)3溶液中:Al3++3OH-═Al(OH)3 | |
| C. | MgO溶于稀HCl中:O2-+2H+═H2O | |
| D. | 铝溶解在NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
分析 A.氢氧化铝为难溶物,离子方程式中不能拆开;
B.氨水为弱碱,离子方程式中一水合氨不能拆开;
C.氧化镁不能拆开,应该保留化学式;
D.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气.
解答 解:A.Al(OH)3溶于稀H2SO4中,氢氧化铝需要保留化学式,正确得到离子方程式为:Al(OH)3+3H+═Al3++3H2O,故A错误;
B.氨水与氯化铝反应生成氢氧化铝沉淀和氯化铵,一水合氨不能拆开,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B错误;
C.MgO溶于稀HCl中生成氯化镁和水,正确的离子方程式为:MgO+2H+═H2O+Mg2+,故C错误;
D.铝溶解在NaOH溶液中,反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:解答题
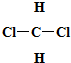 和
和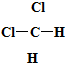 ⑥CH3CH2CH2CH3和
⑥CH3CH2CH2CH3和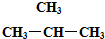
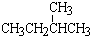 ;
; ③
③ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把煤块变成煤粉燃烧更为剧烈 | |
| B. | 锌与稀硫酸反应制H2时加入少量CuSO4溶液而使反应速率加快 | |
| C. | 固态FeCl3和固态NaOH混合后,加入水能迅速产生沉淀 | |
| D. | 双氧水中加入少量MnO2,即可迅速放出气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaOH溶液和盐酸的体积相等 | B. | 消耗铝的质量相等 | ||
| C. | 两反应中转移的电子数相等 | D. | 反应后两溶液的pH均小于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含等物质的量的HCl、Na2CO3、CH3COOH的混合溶液 | |
| B. | 0.01mol•L-1的盐酸和pH=12的氢氧化钡溶液等体积混合 | |
| C. | 0.05mol•L-1的H2SO4溶液和0.1mol•L-1的KOH溶液等体积混合 | |
| D. | 非电解质溶于水得到的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该原子的摩尔质量是aNA | |
| B. | mg该原子中含有aNA个原子 | |
| C. | mg该原子的物质的量一定是$\frac{m}{a{N}_{A}}$mol | |
| D. | 阿伏加德罗常数NA=$\frac{12}{α}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
| 实验 编号 | 铜片 质量/g | 0.1mol•L-1 硝酸/mL | 硝酸铜 溶液/mL | 亚硝酸钠 溶液/mL | 水的体积 /mL | 实验目的 |
| ① | 5 | 20 | 0 | 0 | 0.5 | 实验①和②探究Cu2+对实验的影响;实验①和③探究亚硝酸根的影响. |
| ② | 5 | 20 | 0.5 | 0 | 0 | |
| ③ | 5 | 20 | 0 | X | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com