
| A. | NaOH溶液和盐酸的体积相等 | B. | 消耗铝的质量相等 | ||
| C. | 两反应中转移的电子数相等 | D. | 反应后两溶液的pH均小于7 |
分析 足量铝粉分别投入等物质的量浓度的NaOH溶液和盐酸中,发生反应:2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,生成的氢气相等,假设生成的氢气的物质的量为3mol,根据方程式计算生成氯化铝、偏铝酸钠的物质的量,混合后铝离子再与偏铝酸根发生水解反应,以此解答该题.
解答 解:足量铝粉分别投入等物质的量浓度的NaOH溶液和盐酸中,发生反应:2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
A.参加反应的铝相等,分别生成NaAlO2、AlCl3,根据铝元素守恒NaAlO2、AlCl3物质的量相等,根据钠离子是故n(NaOH)=n(NaAlO2),根据氯离子守恒n(HCl)=3n(AlCl3),盐酸与氢氧化钠的浓度相同,故消耗的氢氧化钠与盐酸的体积之比等于1:3,故A错误;
B.属提供的电子相等,故消耗的铝的物质的量相等,故B正确;
C.反应中铝作还原剂,氢气是还原产物,生成的氢气的体积相等,金属提供的电子相等,故C正确;
D.反应后氢氧化钠溶液生成偏铝酸钠,溶液仍呈碱性,故D错误.
故选AD.
点评 本题考查铝单质及化合物的性质、化学计算等,为高频考点,侧重于学生的分析能力和实验能力的考查,难度中等,注意把握反应的方程式.


科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 Na2CO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| B. | pH=12的Ba(OH)2溶液和pH=12的NaHCO3溶液中,水电离的c(H+)相等 | |
| C. | 将0.2 mol•L-1 NaA溶液和0.1 mol•L-1盐酸溶液等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) | |
| D. | 常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后c(OH-)<c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;
 ),完成以邻甲基苯酚(
),完成以邻甲基苯酚( )和乙醇为原料制备合成
)和乙醇为原料制备合成 的路线流程图.
的路线流程图. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两容器中分子间的平均距离不相同 | |
| B. | 两容器中所含微粒的质量均相同 | |
| C. | 两容器中所含原子数、分子数、中子数均相同 | |
| D. | 两容器中所含质子数、中子数均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲为K2SO4溶液 | B. | 乙为K2CO3溶液 | C. | 戊为Fe(NO3)3溶液 | D. | 丁为(NH4)2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3溶于稀H2SO4中:OH-+H+═H2O | |
| B. | 氨水滴入Al(Cl)3溶液中:Al3++3OH-═Al(OH)3 | |
| C. | MgO溶于稀HCl中:O2-+2H+═H2O | |
| D. | 铝溶解在NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
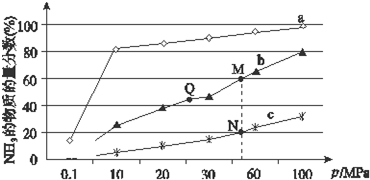
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
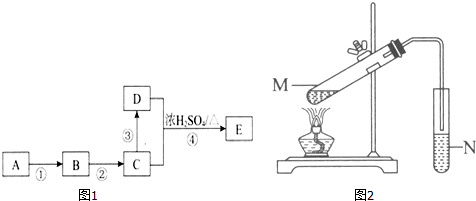
 CH3COOC2H5+H2O;下列说明该反应已经达到化学平衡状态的是ad.
CH3COOC2H5+H2O;下列说明该反应已经达到化学平衡状态的是ad.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com