
【题目】下面是实验室制取少量固体氧化铜的实验,根据实验步骤,回答有关问题。

(1)调整天平零点时,若指针偏向右边,应将左边的螺丝____________(填“向左”或“向右”)旋动。
(2)滴加NaOH溶液,生成沉淀的离子方程式为_______________________________。
(3)加热蒸发过程中要用到玻璃棒,其作用是_________________________________。
(4)洗涤该沉淀的方法是______________________________________________________,为了检验此沉淀是否洗涤干净,应取最后一次的洗涤液少许,加入__________溶液检验。
(5)若向CuSO4溶液中滴加了100mLNaOH溶液,则NaOH溶液的物质的量浓度至少为_________。
(6)理论上最多可以制得CuO的质量为 _______________。
【答案】向左 Cu2++2OH-═Cu(OH)2↓ 搅拌,防止因局部过热引起液体物质飞溅 向过滤器中加入蒸馏水浸没沉淀,等待水自然流尽后,重复操作2~3次 BaCl2或Ba(NO3)2 0.4 mol/L 1.6 g
【解析】
(1)若指针偏向右边,说明右边重,左边轻,应将左边的螺丝向左旋动,因此,本题正确答案是:向左;
(2) 硫酸铜与NaOH溶液反应生成氢氧化铜蓝色沉淀和硫酸钠,离子方程式为:Cu2++2OH-═Cu(OH)2↓;综上所述,本题答案是:Cu2++2OH-═Cu(OH)2↓。
(3)加热蒸发过程中要用到玻璃棒不断地搅拌,防止因局部过热引起液体物质飞溅;综上所述,本题答案是:搅拌,防止因局部过热引起液体物质飞溅。
(4)洗涤该沉淀的方法是:向过滤器中加入蒸馏水浸没沉淀,等待水自然流尽后,重复操作2~3次;为了检验此沉淀是否洗涤干净,应取最后一次的洗涤液少许,加入BaCl2或Ba(NO3)2溶液,若不出现白色沉淀,说明沉淀已经洗涤干净;综上所述,本题答案是:向过滤器中加入蒸馏水浸没沉淀,等待水自然流尽后,重复操作2~3次;BaCl2或Ba(NO3)2。
(5)硫酸铜晶体的物质的量为5/250=0.02mol,则CuSO4为0.02mol,由CuSO4+2NaOH=Cu(OH)2↓+Na2SO4可以知道,需要NaOH物质的量为0.02×2=0.04mol;则NaOH溶液的物质的量浓度至少为0.04/0.1=0.4 mol/L;综上所述,本题答案是:0.4 mol/L。
(6)根据铜元素守恒可知,CuSO4—CuO;CuSO4为0.02mol,所以CuO的质量0.02×80= 1.6 g;综上所述,本题答案是:1.6 g。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知元素X,Y的核电荷数分别是a和b,它们的离子Xm+和Yn﹣的核外电子排布相同,则下列关系式中正确的是( )
A.a=b+m+n
B.a=b﹣m+n
C.a=b+m﹣n
D.a=b﹣m﹣n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于目前常用元素周期表的说法中正确的是( )
A.第ⅢB族元素种类最多
B.只有第3列到第12列全部是金属元素
C.周期数大于或等于族的序数时,一定是金属元素
D.是按原子的质量数由小到大的顺序编制的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl3)俗名磷酰氯、氧氯化磷,是重要的基础化工原料,可用于制取染料、农药,有机合成的氯化剂、催化剂和阻燃剂等。某化学实验小组模拟PCl3直接氧化法制备POCl3,其实验装置设计如下:
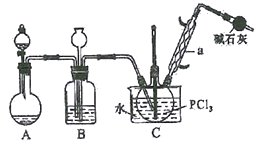
有关物质的部分性质如下表:
熔点/℃ | 沸点/℃ | 其他 | |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
回答下列问题:
(1)仪器a的名称是__________,装置A中发生反应的化学方程式为__________________。
(2)B中所装试剂为__________,B装置的作用除观察O2的流速之外,还有_____________________。
(3)C装置控制反应在60℃~65℃进行,其控温的主要目的是__________。
(4)实验制得的POCl3粗产品中常含有PCl3,可用__________方法提纯。
(5)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取ag产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000mol·L-1的AgNO3溶液40.00mL,使Cl-完全沉淀。
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖,以防止在滴加NH4SCN时,将AgCl沉淀转化为AgSCN沉淀。
Ⅳ.加入指示剂,用cmol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是__________ (填标号)。
a.FeCl2 b.甲基橙 c.淀粉 d.NH4Fe(SO4)2
②Cl元素的质量百分含量为__________ (列出算式)。
③在步骤Ⅲ中,若无加入硝基苯的操作,所测Cl-元素含量将会__________(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F具有独特的生理药理作用,实验室由芳香化合物A制备F的一种合成路线如下:
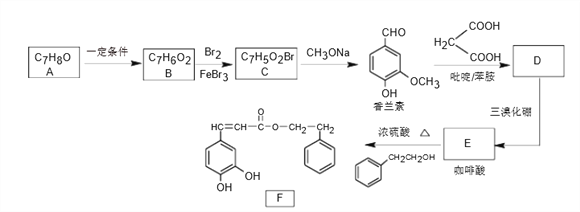
已知:①R-Br![]() R-OCH3 ②R-CHO+
R-OCH3 ②R-CHO+![]() R-CH=CH-COOH
R-CH=CH-COOH
③A能与FeCl3溶液反应显紫色
(1)A的名称为_________________,B生成C的反应类型为__________________。
(2)D的结构简式为________________________。
(3)E中含氧官能团名称为_______________。
(4)写出F与足量NaOH溶液反应的化学方程式__________________________。
(5)G为香兰素的同分异构体,其中能同时满足下列条件的共有______种。(不考虑立体异构)
①能发生银镜反应
②本环上只有3个取代基
③1molG能与足量金属钠反应产生22.4LH2(标准状况)其中核磁共振氢谱有5组峰,且峰面积比为1∶1∶2∶2∶2的结构简式__________。(写一种即可)
(6)根据上述合成中提供的信息,写出以![]() 为原料(其他试剂任选)分三步制备肉桂酸(
为原料(其他试剂任选)分三步制备肉桂酸(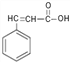 )的合成路线。_____________________________________________
)的合成路线。_____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中物质的分类组合完全正确的是
编号 | A | B | C | D |
强电解质 | KNO3 | H2SO4 | BaSO4 | HClO4 |
弱电解质 | HClO4 | CaCO3 | HClO | NH3·H2O |
非电解质 | SO2 | CS2 | H2O | C2H5OH |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝单质的化学性质以相似性为主,但也存在某些较大差异性,下列物质能用于证明二者存在较大差异性的是( ) ①CO2 ②盐酸 ③NaOH溶液 ④水.
A.①④
B.②③
C.①③
D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2![]() 2SO3并达到平衡。若在这一过程中,甲容器保持体积不变,乙容器保持压强不变,则关于甲、乙两容器说法正确的是( )
2SO3并达到平衡。若在这一过程中,甲容器保持体积不变,乙容器保持压强不变,则关于甲、乙两容器说法正确的是( )
A. 达平衡时间甲比乙短
B. 乙容器中再充入等物质的量的SO2和O2,重新达平衡时转化率减小
C. 达平衡时,甲中SO2的浓度比乙中SO2的浓度大
D. 达平衡时,甲的转化率比乙低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com