
【题目】常温下,将0.1molL﹣1氢氧化钠溶液与0.06molL﹣1硫酸溶液等体积混合,该混合溶液的pH等于( )
A.1.7
B.2.0
C.12.0
D.12.4
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】下列有关反应原理与化学反应方程式相符的是( )
A.过量的铁粉在氯气中燃烧:Fe+Cl2 ![]() FeCl2
FeCl2
B.金属钠在空气中燃烧:4Na+O2 ![]() 2Na2O
2Na2O
C.高炉炼铁中,还原铁矿石:2Fe2O3+3C ![]() 4Fe+3CO2
4Fe+3CO2
D.金属镁着火,不能用CO2灭火:2Mg+CO2 ![]() 2MgO+C
2MgO+C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4溶液与K2C2O4溶液混合反应,产物之一是某种只含一种阴离子的蓝色钾盐水合物.通过下述实验确定该晶体的组成.
步骤a:称取0.6720g样品,放入锥形瓶,加入适量2molL﹣1稀硫酸,微热使样品溶解.再加入30mL水加热,用0.2000molL﹣1 KMnO4溶液滴定至终点,消耗8.00mLKMnO4溶液.
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色.冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI.用0.2500molL﹣1 Na2S2O3标准溶液滴定至终点,消耗8.00mLNa2S2O3溶液.
已知涉及的部分反应的离子方程式为:
步骤a:2MnO4﹣+5C2O42﹣+16H+=2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I﹣=2CuI↓+I2 I2+2S2O32﹣=2I﹣+S4O62﹣
(1)已知室温下CuI的Ksp=1.27×10﹣12 , 欲使溶液中c(Cu+)≤1.0×10﹣6molL﹣1 , 应保持溶液中c(I﹣)≥molL﹣1 .
(2)MnO4﹣在酸性条件下,加热能分解为O2 , 同时生成Mn2+ .
写出该反应的离子方程式为 .
若无此加热操作,则测定的Cu2+的含量将会(填“偏高”、“偏低”或“不变”).
(3)步骤b用淀粉溶液做指示剂,则滴定终点观察到的现象为 .
(4)通过计算确定样品晶体的组成.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的原电池装置,X,Y为两个电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列叙述正确的是( ) 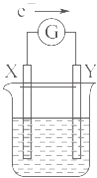
A.外电路中的电流方向为:X→外电路→Y
B.若两个电极分别为Zn和碳棒,则X为碳棒,Y为Zn
C.若两个电极都是金属,则它们的活动性为X>Y
D.X极上发生的是还原反应,Y极上发生的是氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将30ml 0.5mol/LNaOH溶液加水稀释到500ml,稀释后溶液中NaOH的物质的量浓度为( )
A. 0.3mol/L B. 0.03mol/L C. 0.05mol/L D. 0.04mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三位同学分别做了以下三个实验.
实验一:草酸晶体(H2C2O4)和浓硫酸混合缓慢加热时,可发生如下反应:H2C2O4=CO2↑+CO↑+H2O.甲同学设计了如图1实验装置,用来制取干燥纯净的CO气体,并用生成的CO气体还原FexOy , 制取铁粉.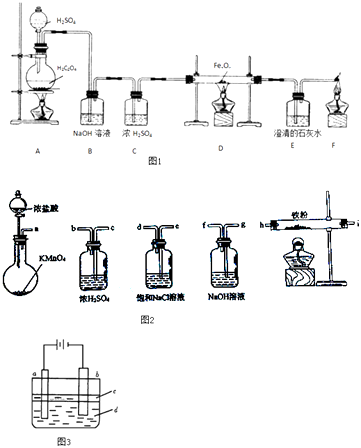
(1)装置B的作用是 . 装置E中的现象是 . 装置F的作用是 .
(2)若FexOy为0.4g,生成的气体与过量澄清石灰水反应生成0.75g白色沉淀,则FexOy的化学式为 .
实验二:乙同学用如图2所示仪器在实验室制备少量无水FeCl3 , 按气流由左到右顺序,仪器连接顺序的是 .
实验三:丙同学用如图3实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.
①a电极材料为 , 其电极反应式为 .
②液体c为苯,其作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、氧是同周期相邻的三种元素,碳、氮、氧及其化合物在生活、生产和科技等方面有重要的应用.请回答下列问题:
(1)碳、氮、氧的第一电离能由大到小顺序为
(2)H2O的中心原子杂化轨道空间构型为 , 固态H2O的晶体类型为 ,
(3)比较键角的大小:H2OCH4(填“>”“<”或“=”),原因为
(4)元素M的离子与NH4+所含电子数和质子数均相同,则M的原子结构示意图为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO47H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%). 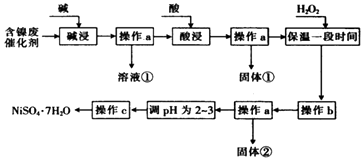
部分阳离子以氢氧化物形式沉淀时的pH如表:
沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
Al(OH)3 | 3.8 | 5.2 |
Fe(OH)3 | 2.7 | 3.2 |
Fe(OH)2 | 7.6 | 9.7 |
Ai(OH)2 | 7.1 | 9.2 |
(1)“碱浸”过程中发生反应的离子方程式是
(2)“酸浸”时所加入的酸是(填化学式).
(3)加入H2O2时发生反应的离子方程式为
(4)操作b为调节溶液的pH,你认为pH的调控范围是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com