
第三周期第ⅡA、ⅢA族金属元素的原子失去电子后,生成的阳离子的电子层结构( )。
A.与它同周期稀有气体元素原子的电子层结构相同
B.与它上一周期稀有气体元素原子的电子层结构相同
C.与它下一周期稀有气体元素原子的电子层结构相同
D.以上说法都不全面
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:单选题
依据元素周期表及元素周期律,下列推断中正确的是
| A.同一周期元素的原子,半径越小越容易失去电子 |
| B.ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| C.向氢硫酸溶液中滴入氯水有单质硫生成,可以验证硫元素的非金属性比氯元素弱 |
| D.主族元素的最高正化合价等于该元素原子的核外电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
铋(Bi)在医药方面有重要应用。下列关于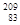 Bi和
Bi和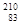 Bi的说法正确的是( )
Bi的说法正确的是( )
A.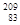 Bi和 Bi和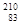 Bi都含有83个中子 Bi都含有83个中子 |
B.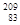 Bi和 Bi和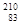 Bi互为同位素 Bi互为同位素 |
C.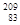 Bi和 Bi和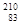 Bi的核外电子数不同 Bi的核外电子数不同 |
D.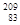 Bi和 Bi和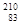 Bi分别含有126和127个质子 Bi分别含有126和127个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素X、Y、Z在周期表中的位置关系如下图所示,据此回答下列问题: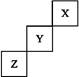
(1)X元素形成单质的化学式是 ;
(2)写出Y元素形成的单质与水反应的化学方程式 ;
(3)写出单质Z与钠反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
卤素单质可以参与很多化学反应, 如:NF3可由NH3和F2在Cu催化剂存在下反应直接得到;反应①: 2NH3+3F2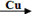 NF3+ 3NH4F
NF3+ 3NH4F
利用“化学蒸气转移法”制备TaS2晶体; 反应②:TaI4(g)+S2(g)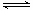 TaS2(s)+2I2(g)+Q kJ,Q>0
TaS2(s)+2I2(g)+Q kJ,Q>0
(1)反应①中:非金属性最强的元素原子核外有_________种不同运动状态的电子;该反应中的某元素的单质可作粮食保护气,则该元素最外层的电子有____________种自旋方向。
(2)反应①中:物质所属的晶体类型有________________________________;
并写出所有原子符合8电子稳定结构的化合物的电子式_______________________。
(3)反应②中:平衡常数表达式K=_____________________,若反应达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 ______________。
| A.平衡常数K增大 | B.S2的浓度减小 | C.I2的质量减小 | D.V(TaI4)逆 增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
(双选)酸根离子R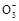 所含电子数比硝酸根离子N
所含电子数比硝酸根离子N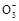 所含的电子数多10个,则下列说法正确的是( )。
所含的电子数多10个,则下列说法正确的是( )。
| A.R原子的电子层数比氮原子的电子层数多1 |
B.酸根离子R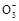 中R的化合价与硝酸根离子N 中R的化合价与硝酸根离子N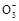 中N的化合价相等 中N的化合价相等 |
C.R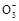 和N 和N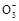 只能被还原,不能被氧化 只能被还原,不能被氧化 |
| D.R原子和氮原子的最外层电子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
(双选)关于碱金属单质的性质叙述错误的是( )。
| A.在空气中燃烧的生成物都是过氧化物 |
| B.与水反应都能生成碱和氢气 |
| C.熔、沸点随原子序数增加而升高 |
| D.还原性随原子电子层数的增加而增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X元素原子的质量数为m,核内中子数为n,则W g X+含有电子的物质的量(mol)是( )。
| A.(m-n)×W/m | B.(m-n-1)×W/m | C.(m+n)×W/m | D.(m-n+1)×W/m |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com