
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
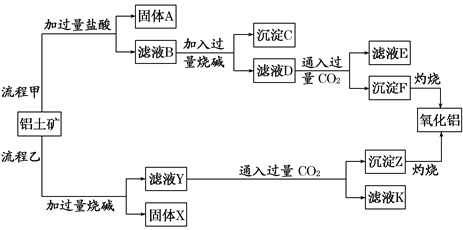
(1)写出流程甲加入盐酸后生成Al3+的离子方程式:___________________________。
(2)写出流程乙加入烧碱后生成SiO![]() 的离子方程式:___________________________。
的离子方程式:___________________________。
(3)为了验证滤液B中含Fe3+,可取少量滤液并加入___________(填试剂名称)。
(4)滤液E 、K中溶质的主要成分是_____(填化学式),写出该溶液的一种用途:_______。
【答案】 2Al+6H+==2Al3++3H2↑ SiO2 +2OH-==SiO32- +H2O 硫氰化钾 NaHCO3 灭火器或制糕点
【解析】由工艺流程甲可知,铝土矿与盐酸反应得固体A和滤液B,则固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠和NaOH,向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为氢氧化铝,滤液E中含有NaCl、NaHCO3;根据工艺流程乙可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体X为Fe2O3、MgO,滤液Y为硅酸钠、偏铝酸钠,滤液中通入过量二氧化碳,沉淀Z为氢氧化铝、硅酸,滤液K中含有NaHCO3,则
(1)根据以上分析可知流程甲加入盐酸后生成Al3+的离子方程式为2Al+6H+=2Al3++3H2↑。(2)根据以上分析可知流程乙加入烧碱后生成SiO32-的离子方程式为SiO2+2OH-=SiO32-+H2O。(3)为了验证滤液B中含Fe3+,可取少量滤液并加入硫氰化钾。(4)根据以上分析可知滤液E、K中溶质的主要成分是NaHCO3,该碳酸氢钠的用途有作灭火器或制糕点。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】根据要求写出下列的方程式。
(1)过氧化钠与水反应的化学方程式:________;
(2)硫酸铝溶液与氨水反应的离子方程式:________;
(3)铁单质与水蒸气反应的化学方程式:________;
(4)二氧化硅与氢氟酸反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓H2SO4 , B中盛有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液. 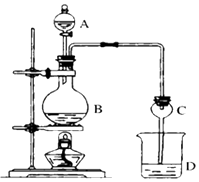
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl26C2H5OH.
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者(设18O℃在CH3CH2OH中),写出能表示18O位置的化学方程式 .
(2)球形干燥管C的作用是 . 若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示):;反应结束后D中的现象是 .
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出;再加入无水硫酸钠,然后进行蒸馏,收集产品乙酸乙酯时,温度应控制在左右.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是立方烷的球棍模型,下列有关说法不正确的是( ) 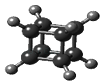
A.它的一氯代物只有一种同分异构体
B.它的二氯代物有两种同分异构体
C.它的分子式为C8H8
D.它与苯乙烯(C6H5﹣CH=CH2)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2CO2+6H2CH2═CH2+4H2O可用于合成烯烃.下列有关说法错误的是( )
A.增大压强可加快该反应速率
B.升高温度能加快该反应速率
C.增大H2的浓度能加快该反应速率
D.密闭容器中,通入略过量的CO2可以实现H2的100%转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息,回答下列问题: 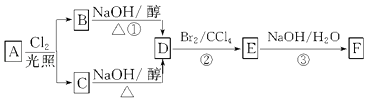
A在氧气中充分燃烧可以产生88g CO2和45g H2O.
(1)A的分子式是 .
(2)B和C均为一氯代烃,反应后只生产D,B、C的名称(系统命名)分别为、 .
(3)D的结构简式 , D中碳原子是否都处于同一平面? .
(4)E的同分异构体的结构简式是 .
(5)①、③的反应类型依次是、 .
(6)写出③的反应化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH 下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH 下列叙述不正确的是( )
A.放电时负极反应为:3Zn﹣6e﹣+6OH﹣═3Zn(OH)2
B.充电时阳极反应为:Fe(OH)3﹣3e﹣+5OH﹣═FeO42﹣+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被还原
D.充电时阴极溶液的碱性减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com