解:(1)反应中Cl元素化合价由+5价降低为KCl中-1价,氧元素由-2价升高为O
2中0价,转移电子数为12,用双线桥表示其电子转移情况为:

,
故答案为:
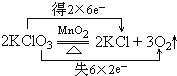
;
(2)反应中KMnO
4→MnCl
2,Mn元素化合价由+7价降低为+2价,共降低5价,HCl→Cl
2↑,Cl元素化合价由-1价升高为0价,共升高2价,化合价升降最小公倍数为10,故KMnO
4的系数为2,Cl
2的系数为5,结合原子守恒配平后方程式为:2KMnO
4+16 HCl(浓)=2KCl+2MnCl
2+5Cl
2↑+8H
2O,反应中转移电子数目为10,标出电子转移情况为:
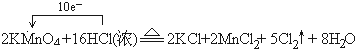
,
故答案为:

;
(3)反应中N元素化合价由KNO
3中+5价降低为N
2中0价,S元素化合价由单质硫中0价降低为K
2S中-2价,
KNO
3、S是氧化剂,C元素由单质碳中的0价升高为CO
2中+4价,碳发生氧化反应生成CO
2,CO
2是氧化产物,
故答案为:KNO
3、S;CO
2.
分析:(1)反应中Cl元素化合价由+5价降低为KCl中-1价,氧元素由-2价升高为O
2中0价,转移电子数为12;
(2)反应中KMnO
4→MnCl
2,Mn元素化合价由+7价降低为+2价,共降低5价,HCl→Cl
2↑,Cl元素化合价由-1价升高为0价,共升高2价,化合价升降最小公倍数为10,据此结合原子守恒配平,标出电子转移情况;
(3)所含元素化合价降低的反应物是氧化剂,所含元素化合价升高的反应物是还原剂,还原剂发生氧化反应生成氧化产物.
点评:本题考查氧化还原反应配平、基本概念、电子转移表示方法等,难度不大,注意对基础知识的理解掌握.

 2KCl+3O2↑(请用双线桥表示其电子转移情况)
2KCl+3O2↑(请用双线桥表示其电子转移情况) ,
, ;
;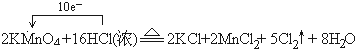 ,
, ;
;

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
 现有五种1~20号元素组成A~I纯净物(试剂X除外),转化关系如下
现有五种1~20号元素组成A~I纯净物(试剂X除外),转化关系如下
