

| ||
| △ |
| ||
| △ |
| ||
| △ |
| ||
| △ |
| 4.4g |
| 44g/mol |
| 2.4g |
| 16g/mol |


科目:高中化学 来源: 题型:阅读理解
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 | 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源:2014届陕西省岐山县高三上学期期中质量检测化学试卷(解析版) 题型:实验题
钴(Co)的氧化物是一种重要的化工原料,工业上利用CoCO3+O2→CoxOy+ CO2反应来生产相应的钴的氧化物。实验室中可以用下列装置来制取钴的氧化物并测定其分子组成。

请填写下列空白:
(1)写出A装置的大试管里发生反应的化学方程式 ;
(2)E装置的U形管里盛放的物质是 ;
A.P2O5 B.无水CaCl2 C.碱石灰 D.无水CuSO4
(3)O3的氧化性比O2强。已知制得的O2中含有少量的Cl2和O3,则B装置中所盛放的物质是
A.NaOH溶液 B.饱和NaHCO3溶液 C.饱和NaCI溶液 D.KI溶液
(4)实验结束时,若先撤去A装置中的酒精灯,会引起 ;
(5)在CoCO3完全转化为CoxOy后,若称得E管增重4.40g,D管内残留物质的质量是8.30g,则生成CoxOy的化学式为 ;
(6)此实验装置存在一个比较大的缺陷,如何完善 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
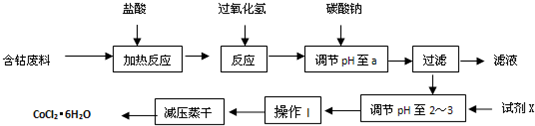
科目:高中化学 来源:2012-2013学年辽宁省大连二十四中高三(上)期中化学试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com