
【题目】下列描述中正确的是( )
A. ClO3-的空间构型为平面三角形
B. 乙炔分子中的两个碳原子采用sp2杂化方式
C. CS2为V形的极性分子
D. SiF4和SO32-的中心原子均为sp3杂化
科目:高中化学 来源: 题型:
【题目】磺化钠在医药中用作甲状腺肿瘤防治剂、袪痰剂和利尿剂,也用作食品添加剂、感光剂等。工业上用水合肼(N2H4·H2O)还原法制取碘化钠固体,其制备流程如图所示:
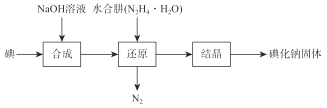
己知:N2H4·H2O在100℃以上分解。
(1)在合成NaI的过程中,可能混有的物质是_______,生产过程中要适当补充NaOH,目的是________。
(2)在还原过程中,为了防止水合肼(N2H4·H2O)高温分解,反应温度控制在60~70℃,温度也不能过低,其原因是___________。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是_____________________。
(3)请设计一个简单的实验来检验还原液中是否含有IO3-:__________________。(可供选择的试剂:稀硫酸、淀粉溶液、FeCl3溶液)
(4)测定产品中NaI含量的实验步骤如下:
a.称取4.000 g样品并溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入A溶液作指示剂;
c.用0.1000mol·L-1的Na2S2O3溶液滴定至终点(发生反应方程式为:2Na2S2O3+I2=Na2S4O6+2NaI),重复测定3次,所得的相关数据如表所示:
测定序号 | 待测体积/ml | 盛装标准滴定管的起点读数/ml | 盛装标准滴定管的终点读数/ml |
1 | 25.00 | 0.06 | 24.04 |
2 | 25.00 | 0.02 | 24.02 |
3 | 25.00 | 0.12 | 24.14 |
①在滴定过程中,Na2S2O3溶液应放___________(填仪器)中;加入的A物质为____________(填名称)。
②滴定终点观察到的现象为_______________________。
③该样品中NaI的含量为_______________________。
④若用上述方法测得NaI的含量偏低(忽略测定过程中的误差),则可能的原因是_________________。
(5)碘化钠固体的保存方法是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为 11℃,可用于处理含硫废水。某小组在实验室中探究 ClO2 与 Na2S 的反应。回答下列问题:
(1)ClO2 的制备
已知:SO2+2NaClO3+H2SO4=2ClO2↑+2NaHSO4
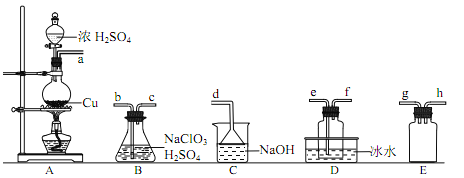
①装置 A 中反应的化学方程式为____________。
②欲收集干燥的 ClO2,选择上图中的装置,其连接顺序为 a→________________(按气流方向,用小写字母表示)
③装置 D 的作用是__________________。
(2)ClO2 与 Na2S 的反应
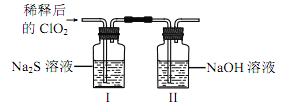
将上述收集到的 ClO2 用 N2 稀释以增强其稳定性,并将适量的稀释后的 ClO2 通入上图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究 I 中反应的产物。
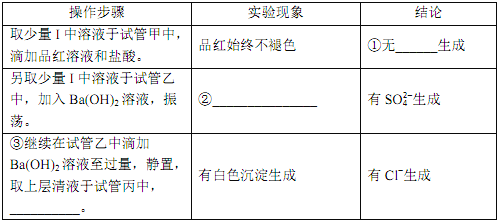
①___________。②___________。③___________。
④ClO2 与 Na2S 反应的离子方程式为____________。用于处理含硫废水时,ClO2 相对于Cl2 的优点是____________(任写一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够用键能解释的是
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液体,碘为固体
C.稀有气体一般很难发生化学反应
D.硝酸易挥发,硫酸难挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数值。下列说法正确的是
A. 常温下,Na2O2与N2和CO2组成的混合气体反应生成0.5mol O2时,转移电子数是2NA
B. 标准状况下,11.2 L的甲醇所含的氢原子数等于2NA
C. 电解饱和食盐水,阳极产生22.4 L气体时,电路中通过的电子数目为2 ![]()
D. 1L 1 mol/L CuCl2溶液中含有的氯离子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,可行的是( )
A.用食醋除去热水瓶中的水垢
B.用米汤检验加碘盐中的碘酸钾(KIO3)
C.向Al2(SO4)3溶液中加过量NaOH溶液,制Al(OH)3
D.向稀H2SO4催化水解后的麦芽糖溶液中直接加入新制Cu (OH)2悬浊液,检验水解产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多金属及它们的化合物在科学研究和工业生产中具有许多用途。回答下列有关问题:
(1)基态Ni核外电子排布式为____________;第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是______________。
(2)配合物 Ni(CO)n的中心原子价电子数与配体提供电子总数之和为 18,则n=_______, CO与N2结构相似,CO分子内σ 键与π键个数之比为_____________。
(3)NiO、FeO的晶体结构类型均与氯化钠的相同, 回答:
①Ni2+和 Fe2+的离子半径分别为69 pm 和78 pm, 则熔点NiO_______FeO(填“<”或“>”);
②NiO晶体中 Ni 的配位数为___________________;
(4) 金属 Cu 单独与氨水或单独与过氧化氢都不能反应, 但可与氨水和过氧化氢的混合溶液反应,其原因是_______________, 反应的离子方程式为_____________________。
(5)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为_______,若该晶胞的边长为a pm,则合金的密度为____g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com