
【题目】许多金属及它们的化合物在科学研究和工业生产中具有许多用途。回答下列有关问题:
(1)基态Ni核外电子排布式为____________;第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是______________。
(2)配合物 Ni(CO)n的中心原子价电子数与配体提供电子总数之和为 18,则n=_______, CO与N2结构相似,CO分子内σ 键与π键个数之比为_____________。
(3)NiO、FeO的晶体结构类型均与氯化钠的相同, 回答:
①Ni2+和 Fe2+的离子半径分别为69 pm 和78 pm, 则熔点NiO_______FeO(填“<”或“>”);
②NiO晶体中 Ni 的配位数为___________________;
(4) 金属 Cu 单独与氨水或单独与过氧化氢都不能反应, 但可与氨水和过氧化氢的混合溶液反应,其原因是_______________, 反应的离子方程式为_____________________。
(5)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为_______,若该晶胞的边长为a pm,则合金的密度为____g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
【答案】 1s22s22p63s23p63d84s2 C(碳) 4 1∶2 > 6 H2O2为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行 Cu+H2O2+4NH3=Cu(NH3)42++2OH- 1∶3 (197+64×3)×1030/(a3Na)
【解析】(1)Ni的原子序数为28,根据能量最低原理可写出电子排布式为1S22S22P63S23P63d84s2,第二周期有2个未成对电子的元素是C和O元素,电负性较小的是C元素;
(2)Ni的家电子数为10,每个配体提供一个电子对,则10+2n=18,n=4;CO与N2结构相似,含有C≡O键,含有1个σ键,2个π键,CO分子内σ键与π键个数之比为1:2;
(3)①Ni2+和Fe2+的离子半径分别为69pm和78pm,离子半径越小,离子键作用力越大,晶体的熔沸点越高,所以熔点NiO>FeO;
②NaCl中钠离子和氯离子的配位数分别为6,NiO的晶体结构类型与氯化钠的相同,NiO晶胞中Ni和O的配位数分别为6;
(4)题中给出了两物质和铜单独不反应,而同时混合能反应,说明两者能互相促进,是两种物质共同作用的结果,其中过氧化氢为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行,方程式可表示为:Cu+H2O2 +4NH3═Cu(NH3)42++2OH-;
(5)在晶胞中,Au原子位于顶点,Cu原子位于面心,该晶胞中Au原子个数=8×![]() =1,Cu原子个数=6×
=1,Cu原子个数=6×![]() =3,所以该合金中Au原子与Cu原子个数之比=1:3,晶胞体积V=(a×10-10cm)3,每个晶胞中铜原子个数是3、Au原子个数是1,则ρ=
=3,所以该合金中Au原子与Cu原子个数之比=1:3,晶胞体积V=(a×10-10cm)3,每个晶胞中铜原子个数是3、Au原子个数是1,则ρ=![]() gcm-3。
gcm-3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. ClO3-的空间构型为平面三角形
B. 乙炔分子中的两个碳原子采用sp2杂化方式
C. CS2为V形的极性分子
D. SiF4和SO32-的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
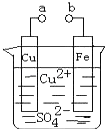
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e﹣=Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成 浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电池的叙述正确的是
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池工作时氢气在负极被氧化
C.太阳能电池的主要材料是高纯度的二氧化硅
D.氢氧燃料电池可将热能直接转变为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物H为芳香酯,其合成路线如下:
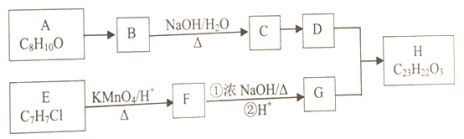
已知以下信息:
①A—H均为芳香族化合物,A的苯环上只有一个取代基,B能发生银镜反应,D的相对分子质量比C大4,E的核磁共振氢谱有3组峰。
② 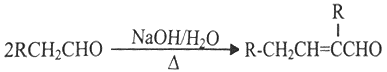
③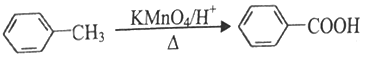
请回答下列问题:
(1)A→B的反应类型为____________,G所含官能团的名称为 ________________。
(2)B与银氨溶液反应的化学方程式为_____________________。
(3)H的结构简式为____________。
(4)符合下列要求的A的同分异构体有________________种。
①遇氯化铁溶液显紫色 ②属于芳香族化合物
其中苯环上有两个取代基的有 ___________________ (写结构简式)
(5)根据已有知识并结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2CH2OH的合成路线流程图(无机试剂任用)______________合成路线流程图示例如下:
CH3CH2Br ![]() CH3CH2OH
CH3CH2OH ![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电负性的大小可以作为判断元素金属性和非金属性强弱的尺度。下列关于电负性的变化规律正确的是( )
A. 周期表从左到右,同周期主族元素的电负性逐渐变大
B. 周期表从上到下,元素的电负性逐渐变大
C. 电负性越大,金属性越强
D. 电负性越小,非金属性越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应:N2+3H3![]() 2NH3是一个放热反应。已知该反应生成2molNH3时,放出92kJ的热量.
2NH3是一个放热反应。已知该反应生成2molNH3时,放出92kJ的热量.
⑴相同条件下,1 mol N2和3 mol H2所具有的能量________(“大于”、“小于”、“等于”)2 molNH3具有的能量;
⑵如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量_______(“大于”、“小于”、“等于”)上述数值,其原因是_____________;
⑶实验室模拟工业合成氨时,在容器为2L的密闭容器内,反应经过10min后,生成10 mol NH3,则用N2表示的该反应速率为:_____________;
⑷一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是_______
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值 d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等 f.反应达到最大限度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com