
【题目】已知1 mol氢气完全燃烧生成水蒸气时放出242 kJ的能量,且氧气中1 mol O===O键完全断裂时需要吸收496 kJ的能量,水蒸气中1 mol H—O键形成时放出463 kJ的能量,则氢气中1 mol H—H键断裂时吸收的能量为
A.436 kJ B.557 kJ C.920 kJ D.181 kJ
科目:高中化学 来源: 题型:
【题目】将SO2通入略显酸性的Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀,在上述一系列变化过程中,最终被还原的微粒是
A.NO3-B.SO2C.Fe2+D.Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】m mol C2H2跟n mol H2在密闭容器中反应,当该可逆反应达到平衡时,生成p mol C2H4。将反应后的混合气体完全燃烧生成CO2和H2O,所需要氧气的物质的量是( )
A.(3m+n)mol B.![]() C.(3m+n+2p)mol D.
C.(3m+n+2p)mol D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用CuSO4溶液,进行以下实验探究。
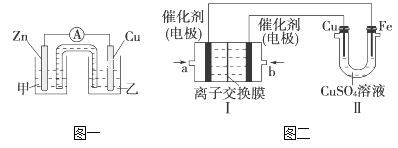
(1)图一是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池。Cu极的电极反应式是_____________________________________________________,
盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向________(填“甲”或“乙”)池移动。
(2)图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是________(填“CH4”或“O2”),a处电极上发生的电极反应是_____________________________________________;
当铜电极的质量减轻3.2 g时,消耗的CH4在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某研究性学习小组设计的对一种废旧合金的各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。

已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mn(OH)2] =1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是 。
(2)加入过量FeCl3溶液过程中可能涉及的化学方程式: 。
(3)过量的还原剂应是 。
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为 。
②若用X mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为 g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为: ﹥ ﹥ 。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Z g,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为 L(用含Z的代数式表示);该电极的反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
(1)碳酸氢钠俗称小苏打,其水溶液显____________性(填“酸”、“碱”或“中”)。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为___________________。等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者____________后者(填“>”、“<”或“=”)。
(3)除去碳酸钠固体中碳酸氢钠的方法是____________(填“加热”或“溶解过滤”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250 ℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:
CO2 (g)+CH4(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=____________。
②已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
CO(g)+H2O (g)===CO2(g)+H2 (g) =2.8 kJ·mol-1
2CO(g)+O2(g)===2CO2(g) =-566.0 kJ·mol-1
反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g) 的ΔH=_____________。
2CO(g)+2H2(g) 的ΔH=_____________。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。250~300 ℃时,温度升高而乙酸的生成速率降低的原因是___________________________________________________________________。

②为了提高该反应中CH4的转化率,可以采取的措施是____________________________________。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为________________________________________________。
(3)①Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是________(填字母)。
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是在500 ℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700 ℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是_________________________________________。
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO![]() CO+H2+O2
CO+H2+O2
高温电解技术能高效实现反应A,工作原理示意图如下:

CO2在电极a放电的反应式是________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com