
【题目】回答下列问题:
(1)将等质量的镁分别与足量的CO2、O2、N2、空气中充分燃烧,反应前后固体增重由大到小的顺序为___。
(2)在常温下,实验室用固体亚硫酸钠和中等浓度的硫酸制取SO2气体。将制得的SO2气体通入紫色石蕊试液,可观察到的现象为___。
(3)在常温下,把NO气体压缩到1.01×108Pa,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力![]() 就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式___。
就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式___。
(4)按如图进行实验,试管中装有NO,然后缓慢地通入84mLO2,充分反应后液面高度不变,则原试管中装有NO的体积为___。
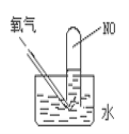
(5)标况下,将一定体积的盛满NO、NO2、O2的混合气体的试管倒立于水槽中,水充满整个试管,则试管内的溶液的物质的量浓度范围是(假定试管内溶液不扩散)为___。
【答案】CO2>O2>空气>N2 溶液变红 3NO=N2O+NO2 48mL 0.0357>c(HNO3)>0.0255或![]() >c(HNO3)>
>c(HNO3)>![]()
【解析】
(1)根据镁在氧气、氮气、二氧化碳中燃烧的方程式计算燃烧后固体的质量;
(2)二氧化硫和水反应生成亚硫酸,亚硫酸能电离出自由移动的氢离子,所以溶液显酸性;
(3)若NO转化为N2O和O2,则气体的压强下降至原来的![]() ,不符合题意;若NO转化为N2O和NO2,少量NO2转化为N2O4,则气体的压强下降至略小于原来的
,不符合题意;若NO转化为N2O和NO2,少量NO2转化为N2O4,则气体的压强下降至略小于原来的 ![]() ,符合题意;
,符合题意;
(4)试管中装有NO的体积为xmL,然后缓慢地通入84mLO2,充分反应后液面高度不变,则剩下氧气为xmL,由阿伏伽德罗定律可知,体积之比等于物质的量之比,可计算;
(5)标况下,将一定体积的盛满NO、NO2、O2的混合气体的试管倒立于水槽中,水充满整个试管,可知三者要完全反应,反生的反应为:4NO+3O2+2H2O=4HNO3和4NO2+O2+2H2O=4HNO3,设试管体积为vL,采用一边倒计算。
(1) 2Mg+O2![]() 2MgO、N2+3Mg
2MgO、N2+3Mg![]() Mg3N2、2Mg+CO2
Mg3N2、2Mg+CO2![]() 2MgO+C,24g镁与O2反应生成1 mol MgO,质量增加16 g;24g镁与N2反应生成
2MgO+C,24g镁与O2反应生成1 mol MgO,质量增加16 g;24g镁与N2反应生成![]() mol Mg3N2,质量增加
mol Mg3N2,质量增加![]() g;24g镁与CO2反应生成1 mol MgO和
g;24g镁与CO2反应生成1 mol MgO和![]() mol C,质量增加22 g,空气的主要成分为氧气和氮气,质量增加介于两者之间,反应前后固体增重由大到小的顺序为CO2>O2>空气>N2,故答案为:CO2>O2>空气>N2;
mol C,质量增加22 g,空气的主要成分为氧气和氮气,质量增加介于两者之间,反应前后固体增重由大到小的顺序为CO2>O2>空气>N2,故答案为:CO2>O2>空气>N2;
(2)二氧化硫和水反应生成亚硫酸,亚硫酸能电离出自由移动的氢离子,所以溶液显酸性,紫色石蕊试液遇酸变红色,继续通入过量SO2 气体,溶液的红色不会褪去,故答案为:溶液变红;
(3)若NO转化为N2O和O2,则气体的压强下降至原来的![]() ,不符合题意;若NO转化为N2O和NO2,少量NO2转化为N2O4,则气体的压强下降至略小于原来的
,不符合题意;若NO转化为N2O和NO2,少量NO2转化为N2O4,则气体的压强下降至略小于原来的 ![]() ,符合题意,所以上述变化的化学方程式:3NO=N2O+NO2,故答案为:3NO=N2O+NO2;
,符合题意,所以上述变化的化学方程式:3NO=N2O+NO2,故答案为:3NO=N2O+NO2;
(4)试管中装有NO的体积为xmL,然后缓慢地通入84mLO2,充分反应后液面高度不变,则剩下氧气为xmL,由阿伏伽德罗定律可知,体积之比等于物质的量之比,根据4NO+3O2+2H2O=4HNO3可得,消耗xmL的NO,会消耗氧气![]() ,则有
,则有![]() +x=84,解得x=48,则原试管中装有NO的体积为48mL,故答案为:48mL;
+x=84,解得x=48,则原试管中装有NO的体积为48mL,故答案为:48mL;
(5)标况下,将一定体积的盛满NO、NO2、O2的混合气体的试管倒立于水槽中,水充满整个试管,可知三者要完全反应,反生的反应为:4NO+3O2+2H2O=4HNO3和4NO2+O2+2H2O=4HNO3,设试管体积为vL,由反应可知,全部为NO、O2时,得到试管内硝酸浓度最小,最小为: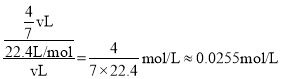 ;全部为NO2、O2时,得到试管内硝酸浓度最大,最大为:
;全部为NO2、O2时,得到试管内硝酸浓度最大,最大为: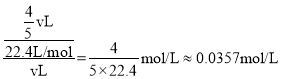 ,反应试管内的溶液的物质的量浓度范围是0.0357>c(HNO3)>0.0255或
,反应试管内的溶液的物质的量浓度范围是0.0357>c(HNO3)>0.0255或![]() >c(HNO3)>
>c(HNO3)>![]() ,故答案为:0.0357>c(HNO3)>0.0255或
,故答案为:0.0357>c(HNO3)>0.0255或![]() >c(HNO3)>
>c(HNO3)>![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,A—I九种元素在元素周期表中的位置如图:

请回答下列问题:
(1)B在周期表中的位置_______;E的离子结构示意图______。
(2)C的最高价氧化物对应的水化物与C的气态氢化物发生反应,生成物中含有的化学键类型是_____。
(3)G、I的最高价氧化物对应的水化物的化学式是_________、_____。
(4)A、D形成的化合物中只含极性键的物质的电子式为______。
(5)F、H的简单离子半径较大的是______(用离子符号表示),H、I的气态氢化物稳定性较强的是____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 等体积等物质的量浓度的CH3COONa(aq)与NaCl(aq)中离子总数大小:N前=N后
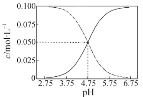
B. 常温下醋酸和醋酸钠混合溶液中c (CH3COOH)、c (CH3COO-)与pH值的关系如图所示,当pH=4.5溶液中:c (CH3COO-)> c (CH3COOH)> c (H+)> c (OH-)
C. 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2 c(Na+)=c(CH3COO-)+ c(CH3COOH)
D. pH相等的盐酸与醋酸溶液,c(Cl-)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次递增,X、Y、Z三种元素的原子序数之和为25,且Z和X的原子序数之和比Y的原子序数的2倍还多1,X原子核外有2个电子层,最外层电子数是核外电子数的2/3;W在所在周期中原子半径最小。回答下列问题:
(1)W在元素周期表中的位置是________________
(2)X的原子结构示意图是___________。
(3)用电子式表示Z2Y的形成过程:____________________。
(4)在Z2XY3溶液中加入足量MgCl2溶液,过滤沉淀,取滤液,再滴加CaCl2溶液,溶液仍然出现白色沉淀,说明Z2XY3与MgCl2的反应存在___________,该反应的离子方程式为__________。
(5)以X的简单氢化物、Y的单质为两电极原料,Z2Y溶于水形成的溶液为电解质溶液,可制备燃料电池。该燃料电池的负极反应为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是某药物中间体L的合成路线:
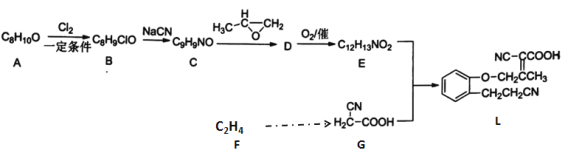
已知:
RCH2COOH![]()
请回答:
(1)有机物A的结构简式________。
(2) 下列说法不正确的是________。
A 有机物A转化成B的条件是铁粉作为催化剂
B 有机物C转化成D原子利用率可达100%
C 用铜丝蘸取有机物B放在酒精灯上灼烧,火焰显绿色
D 有机物D不能使酸性高锰酸钾溶液褪色
(3) E+G→L的化学方程式是________________。
(4) 写出符合下列条件的A的所有同分异构体__________________。
①含有苯环②核磁共振氢谱显示有4种氢原子
(5)设计以F 为原料合成G流程____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:醛分子在稀碱溶液存在下,可发生羟醛缩合反应,生成羟基醛,如:
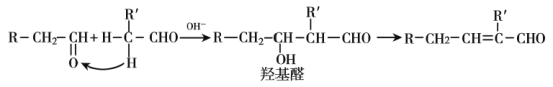
某有机物的合成路线如下:
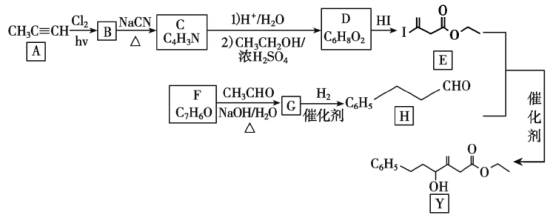
回答下列问题:
(1)A中官能团名称是___,F的名称是___。
(2)由A生成B、G生成H的反应类型分别是___、___。
(3)B为单氯代烃,由B生成C的化学方程式为___。
(4)D的结构简式为___。
(5)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出2种符合上述条件的X的结构简式___。
(6)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。用星号(*)标出Y中的手性碳___。
(7)苯乙酸苄酯(![]() )是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线___(无机试剂任选)。
)是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线___(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】550℃时,有如下反应:2SO2+O2![]() 2SO3 ΔH<0。把2molSO2和1molO2放入恒容的密闭容器中,判断该反应达到平衡状态的标志是( )
2SO3 ΔH<0。把2molSO2和1molO2放入恒容的密闭容器中,判断该反应达到平衡状态的标志是( )
A. SO2和SO3浓度相等
B. 单位时间内反应掉0.2molSO2的同时生成了0.2molSO3
C. 容器中气体的压强不变
D. 容器中混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三只烧杯中,依次分别盛有NaOH溶液、KSCN溶液、煮沸的蒸馏水,各滴入FeCl3溶液,试根据实验现象分别回答以下问题:
(1)分别写出三只烧杯中形成分散系的名称:
A________,B________,C________。
(2)写出C中形成分散系的化学方程式:_____________________________________。
(3)若不用化学试剂鉴别,写出鉴别B、C分散系的两种简单方法:
①______________________________________________________,
②________________________________________________________。
(4)向C中逐滴加入稀H2SO4,现象为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据信息填空:
(1)FeCl3溶液常用于腐蚀印刷电路铜板,发生反应2FeCl3 +Cu ===2FeCl2 +CuCl2,若将此反应设计成原电池,则负极所用的电极材料为____;当线路中转移0.2mol电子时,则被腐蚀的铜的质量为____。
(2)如图所示,把试管放入盛有25℃的饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5 mL盐酸于试管中,可观察到溶液变浑浊,试回答下列问题:
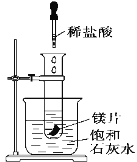
①产生上述现象的原因是___________________________;
②写出有关反应的离子方程式___________________。
③由实验推知,MgCl2和H2的总能量__________(填“大于”、“小于”或“等于”)Mg和HCl的总能量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com