
����Ŀ����֪��ȩ������ϡ����Һ�����£��ɷ�����ȩ���Ϸ�Ӧ�������ǻ�ȩ���磺
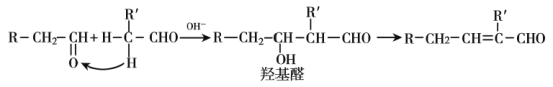
ij�л���ĺϳ�·�����£�
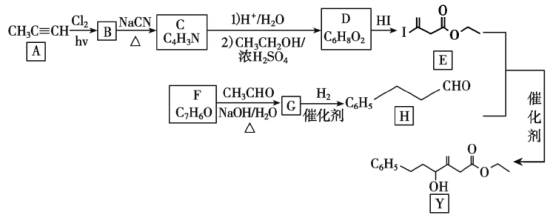
�ش��������⣺
��1��A�����������___��F��������___��
��2����A����B��G����H�ķ�Ӧ���ͷֱ���___��___��
��3��BΪ���ȴ�������B����C�Ļ�ѧ����ʽΪ___��
��4��D�Ľṹ��ʽΪ___��
��5��X��D��Ϊͬ���칹�壬�Ҿ�����ȫ��ͬ�����š�X�ĺ˴Ź���������ʾ���ֲ�ͬ��ѧ�������⣬������֮��Ϊ3��3��2��д��2�ַ�������������X�Ľṹ��ʽ___��
��6��̼ԭ��������4����ͬ��ԭ�ӻ����ʱ����̼��Ϊ����̼�����Ǻ�(*)���Y�е�����̼___��
��7������������(![]() )�ǻ��������ϣ�����ɱ��״�Ϊ��ʼԭ���Ʊ������������ĺϳ�·��___(���Լ���ѡ)��
)�ǻ��������ϣ�����ɱ��״�Ϊ��ʼԭ���Ʊ������������ĺϳ�·��___(���Լ���ѡ)��
���𰸡�̼̼���� ����ȩ ȡ����Ӧ �ӳɷ�Ӧ ![]() HC��CCH2COOC2H5 CH3COOC��CCH2CH3��CH3C��CCOOCH2CH3��CH3COOCH2C��CCH3��CH3C��CCH2COOCH3��CH3CH2COOC��CCH3��CH3CH2C��CCOOCH3������2�֣�
HC��CCH2COOC2H5 CH3COOC��CCH2CH3��CH3C��CCOOCH2CH3��CH3COOCH2C��CCH3��CH3C��CCH2COOCH3��CH3CH2COOC��CCH3��CH3CH2C��CCOOCH3������2�֣� 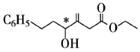

��������
BΪ���ȴ�����˵������������������A����ȡ����Ӧ����B����BΪCH2ClC��CH������C����ʽ֪������C�ķ�ӦΪȡ����Ӧ����CΪNCCH2C��CH��C������������ˮ������HC��CCH2COOH��Ȼ����Ҵ�����������Ӧ����DΪHC��CCH2COOCH2CH3��D��HI�����ӳɷ�Ӧ����E������H�ṹ��ʽ����Ϣ֪��FΪ![]() ��GΪ
��GΪ![]() ��G�����ӳɷ�Ӧ����H��H��E����ȡ����Ӧ����Y�������Ŀ�������
��G�����ӳɷ�Ӧ����H��H��E����ȡ����Ӧ����Y�������Ŀ�������
(1)A�Ľṹ��ʽΪ![]() ������������������̼̼������FΪ
������������������̼̼������FΪ![]() ����ѧ�����DZ���ȩ��
����ѧ�����DZ���ȩ��
(2)�ڹ���������������A����ȡ����Ӧ����B��G��H2�����ӳɷ�Ӧ����H��
(3)BΪCH2ClC��CH����B��NaCN����ȡ����Ӧ����C�Ļ�ѧ����ʽΪ![]() ��
��
(4)�ɷ���֪D�Ľṹ��ʽΪHC��CCH2COOC2H5��
(5)DΪHC��CCH2COOC2H5��X��D��Ϊͬ���칹�壬�Ҿ�����ȫ��ͬ�����ţ���̼̼������������X�ĺ˴Ź���������ʾ���ֲ�ͬ��ѧ�������⣬������֮��Ϊ3��3��2��˵�����ӽṹ�л����ܺ���2��-CH3��һ��-CH2-��������������X�Ľṹ��ʽ��CH3COOC��CCH2CH3��CH3C��CCOOCH2CH3��CH3COOCH2C��CCH3��CH3C��CCH2COOCH3��CH3CH2COOC��CCH3��CH3CH2C��CCOOCH3��6�֣�
(6)Y�Ľṹ��ʽΪ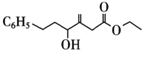 �����ӽṹ�к��е�����̼��(���Ǻ�*���)
�����ӽṹ�к��е�����̼��(���Ǻ�*���) ��
��
(7)�������������ɱ�����ͱ��״�����������Ӧ���ɣ�����������ɱ��״�����HCl����ȡ����Ӧ����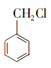 ������
������ ��NaCN����ȡ����Ӧ����
��NaCN����ȡ����Ӧ����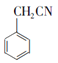 ��Ȼ��
��Ȼ�� ˮ�⼴�ɵõ������ᣬ���ɱ��״�Ϊ��ʼԭ���Ʊ������������ĺϳ�·��Ϊ
ˮ�⼴�ɵõ������ᣬ���ɱ��״�Ϊ��ʼԭ���Ʊ������������ĺϳ�·��Ϊ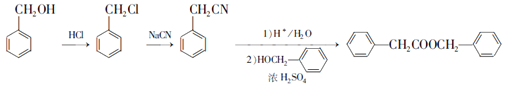 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ����Ҫ�Ļ���ԭ�ϣ������Խ�������ת�������ַ�Ӧ��������Ӧ���������ʡ��

(1)��Ӧ�ٵĻ�ѧ����ʽ��________��
(2)A�Ľṹ��ʽ��________������________��
(3)��Ӧ�����跴Ӧ���A��,����Ҫ________����Ӧ������________��
(4)����ˮ���𱽺��屽�ķ�����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
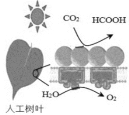
����Ŀ��CO2�IJ����������������ʵ������������ŵ���Ҫ;��֮һ����ش�
(1)������̼�ĵ���ʽΪ__________��
(2)һ�����ڿ��������ö�����̼��ȡ����(HCOOH)��;����ͼ��ʾ��ͼ��������Ҫת����ʽΪ_____________ ��CO2��H2Oת��Ϊ����Ļ�ѧ����ʽΪ____________��
(3)Ŀǰ��ҵ����һ�ַ�������CO2����ȼ�ϼ״���һ�������·�����Ӧ��CO2(g)+3H2(g)CH3OH(g)+H2O(g)��
�ٺ��������У��ܼӿ�÷�Ӧ���ʵ���_______��
a.�����¶� b.����ϵ�з����CH3OH c.�����Ч���� d.����ѹǿ
�������Ϊ2L���ܱ������У�����1molCO2��3molH2�����CO2�����ʵ�����ʱ��仯��ͼ��ʾ���ӷ�Ӧ��ʼ��5minĩ����H2Ũ�ȱ仯��ʾ��ƽ����Ӧ����________________��
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
������ͬ�¶ȡ����ݵ������£���˵���÷�Ӧ�Ѵ�ƽ��״̬����_______(�����)��
a.CO2��H2��CH3OH��H2O��Ũ�Ⱦ����ٸı仯
b.n(CO2):n(H2):n(CH3OH):n(H2O)=1:1:1:1
c.�����л��������ܶȲ���
d.v����(H2)=3v����(CH3OH)
e.��ϵѹǿ����
(4)����һЩ���ۼ��ļ������±���ʾ��
��ѧ�� | H-H | H-O | C=O | C-H | C-O |
����kJ/mol | 436 | 463 | 803 | 414 | 326 |
��ӦCO2(g)+3H2(g)CH3OH(g)+H2O(g)��______(���������������ų���) ������Ϊ_____kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾװ�ý���ʵ�飬���ܵó���Ӧ���۵��ǣ� ��
��Һ�� | ����� | ��Һ�� | ʵ����� |
| |
A | ϡ���� | Na2CO3 | Na2SiO3 | �ǽ����ԣ�S>C>Si | |
B | Ũ���� | KMnO4 | Na2S | �����ԣ�KMnO4>Cl2>S | |
C | ŨH2SO4 | Cu | ������ | ��Һ����� | |
D | Ũ��ˮ | CaO | AlCl3 | �����Ʊ�Al(OH)3 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⣺
��1������������þ�ֱ���������CO2��O2��N2�������г��ȼ�գ���Ӧǰ����������ɴ�С��˳��Ϊ___��
��2���ڳ����£�ʵ�����ù����������ƺ��е�Ũ�ȵ�������ȡSO2���塣���Ƶõ�SO2����ͨ����ɫʯ����Һ���ɹ۲쵽������Ϊ___��
��3���ڳ����£���NO����ѹ����1.01��108Pa����һ������̶�����������ȵ�50�棬���������ѹ��Ѹ���½���ѹ��������С��ԭѹ��![]() �Ͳ��ٸı䣬��֪����һ�ֲ���ΪN2O��д�������仯�Ļ�ѧ����ʽ___��
�Ͳ��ٸı䣬��֪����һ�ֲ���ΪN2O��д�������仯�Ļ�ѧ����ʽ___��
��4������ͼ����ʵ�飬�Թ���װ��NO��Ȼ������ͨ��84mLO2����ַ�Ӧ��Һ��߶Ȳ��䣬��ԭ�Թ���װ��NO�����Ϊ___��
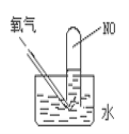
��5������£���һ�������ʢ��NO��NO2��O2�Ļ��������Թܵ�����ˮ���У�ˮ���������Թܣ����Թ��ڵ���Һ�����ʵ���Ũ�ȷ�Χ��(�ٶ��Թ�����Һ����ɢ)Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���2 L�ܱ������У�A��B��C������������ʵ�����ʱ��仯��������ͼ��ʾ������˵����ȷ����
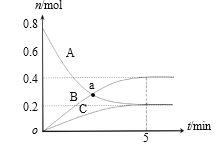
A.a��ʱ����(A) =��(B)
B.��Ӧ��ʼ��5min��B�����ʵ���������0.2 mol
C.��Ӧ�Ļ�ѧ����ʽΪ��3A![]() 2B��C
2B��C
D.��Ӧ��ʼ��5min����(C) =0.04 mol/(L��min)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鷽���ܴﵽʵ��Ŀ�ĵ��ǣ����ּг�װ������ȥ��
|
|
|
|
A֤���������Ա� ����ǿ | Bʵ������ ���������� | Cʵ�����ư��� | D֤��̼���������ȶ� �Ա�̼������ |
A.AB.B��C.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��R��W��X��Y��M��ԭ�����������������������Ԫ�ء�R���ͬλ�ص�ԭ�Ӻ��в������ӡ�W��X���γ������ȶ��Ļ����WX��WX2����ҵ��������������ʹ�õĻ�ʯȼ����ȼ�չ����н�����WX2�����������һ���̶ȵ��µ������ƽ���¶����ߡ�Y��X��ͬһ�����Ԫ�أ�����Ԫ�����ڱ�����X���ڡ�
��1��W��ԭ�ӽṹʾ��ͼ��__________________________��
��2��WX2�ĵ���ʽ��_______________________��
��3��R2X��R2Y�У��ȶ��Խϸߵ���____���ѧʽ�������ԭ�ӽṹ�ĽǶȽ�����ԭ��_____��
��4��Se��Y��ͬһ�����Ԫ�أ�����Ԫ�����ڱ�����Y���ڡ�
�ٸ���Ԫ�������ɣ������ƶ���ȷ����________������ĸ��ţ���
a��Se����������ϼ�Ϊ+7��
b��H2Se�Ļ�ԭ�Ա�H2Yǿ
c��H2SeO3�����Ա�H2YO4ǿ
d��SeO2��һ�������¿���NaOH��Һ��Ӧ
����������SeO2������洵��NH3���ɵõ����ֵ��ʺ�H2O���÷�Ӧ�Ļ�ѧ����ʽΪ_____________��
��5��������Ա�ӿ�ʯ�з����һ���������ѧʽ�ɱ�ʾΪM2O3��Ϊȷ��MԪ�ص����࣬������һϵ��ʵ�飬������£�
��M�����ԭ����������K��Rb��﨣�֮�䣻
��0.01 mol M2O3�ڼ�����Һ����Zn��ַ�Ӧ�ɵõ�M�ļ��⻯���Ӧ��ȫʱ����M2O3������ZnΪ0.06 mol��
�ۺ�������Ϣ�ƶϣ�M����λ��Ԫ�����ڱ���_________________�塣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڵ绯ѧ������˵����ȷ����
A����ҵ���õ��MgCl2��Һ�ķ���ұ��Mg
B����������������ʴ��������ӦʽΪ4OH��-4e���TO2��+2H2O
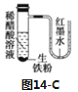
C����ͼ14-C�з�����Ӧ�ķ���ʽΪ��Fe��2H��=Fe2����H2��
D������п�̸ɵ�طŵ�ʱ��������ӦΪ�� MnO2��H2O��e����MnOOH��OH��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com