
【题目】利用图示装置进行实验,不能得出相应结论的是( )
溶液① | 固体② | 溶液③ | 实验结论 |
| |
A | 稀硫酸 | Na2CO3 | Na2SiO3 | 非金属性:S>C>Si | |
B | 浓盐酸 | KMnO4 | Na2S | 氧化性:KMnO4>Cl2>S | |
C | 浓H2SO4 | Cu | 氢硫酸 | 溶液变浑浊 | |
D | 浓氨水 | CaO | AlCl3 | 可以制备Al(OH)3 |
A. A B. B C. C D. D
【答案】C
【解析】A.稀硫酸和碳酸钠反应生成二氧化碳,二氧化碳和硅酸钠溶液反应生成硅酸,强酸制取弱酸,所以酸性:硫酸>碳酸>硅酸,故A正确;B.浓盐酸和高锰酸钾溶液反应生成氯气,氯气能与Na2S溶液反应置换出硫单质,自发进行的同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,第一个反应中高锰酸钾作氧化剂、氯气是氧化产物,第二个反应中氯气是氧化剂、S是氧化产物,所以氧化性:KMnO4>Cl2>S,故B正确;C.常温下Cu和浓硫酸不反应,无SO2气体生成,故C错误;D.生石灰与浓氨水能够生成氨气,氨水为弱碱性,所以氨气通入AlCl3溶液中有Al(OH)3白色沉淀生成,能够得出该结论,故D正确;答案为C。


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】1.
纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法:
窗体顶端
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法,反应为2Cu+H2O |
方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成________而使Cu2O产率降低。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =_____。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,电解装置如下图所示。

①阴极上的产物是________ 。
②阳极生成Cu2O,其电极反应式为_________。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该反应的化学方程式为____________。
(5)肼又称联氨,易溶于水,是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因______。
(6)向1L恒容密闭容器中充入0.1molN2H4,在30℃、Ni-Pt催化剂作用下发生反应N2H4(g)![]() N2(g)+2H2(g),测得混合物体系中,
N2(g)+2H2(g),测得混合物体系中,![]() (用y表示)与时间的关系如图所示。0-4min时间内H2的平均生成速率v(H2)=____mol/(L·min);该温度下,反应的平衡常数=_______。
(用y表示)与时间的关系如图所示。0-4min时间内H2的平均生成速率v(H2)=____mol/(L·min);该温度下,反应的平衡常数=_______。

(7)肼-空气清洁燃料电池是一种碱性燃料电池,电解质溶液时20%-30%的KOH溶液。肼-空气燃料电池放电时,负极的电极反应式是_________。电池工作一点时间后,电解质溶液的pH将_______(填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下充满HCl的烧瓶做完喷泉实验后得到稀盐酸,用标准碳酸钠溶液滴定这种盐酸测定它的准确浓度,请你回答下列问题:
(1)用标准Na2CO3溶液滴定这种盐酸时,Na2CO3溶液应装在_______式滴定管内,原因是(文字叙述并用有关离子方程式表示): ;若用甲基橙作指示剂,达到滴定终点时,溶液从_______色变为_______色。
(2)现配制三种浓度的标准Na2CO3溶液,你认为最合适的是下列第______种(填序号)。
①2.500 mol/L ②0.25 mol/L ③0.025mol/L
(3)若采用上述合适浓度的标准Na2CO3溶液滴定,用C(Na2CO3)表示,滴定时实验数据列表如下:
实验编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
1 | 20.00 | 18.80 |
2 | 20.00 | 16.95 |
3 | 20.00 | 17.05 |
根据以上数据计算时应带入的Na2CO3溶液体积为_________,求这种待测盐酸的物质的量浓度(用数据和符号列式即可):C(HCl)=_________ 。
(4)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人们的生产、生活息息相关。下列有关说法正确的是:
A.煤的干馏和石油的分馏都属于化学变化
B.绿色化学的核心是应用化学原理对环境污染进行治理
C.区分食盐是否加碘的方法是向食盐溶液中加少量淀粉,观察其是否变蓝
D.铝制容器不宜用来长时间存放酸性和碱性食物,也不可长时间存放含盐腌制食品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以芳香烃A为原料合成有机物F和I的合成路线如下:
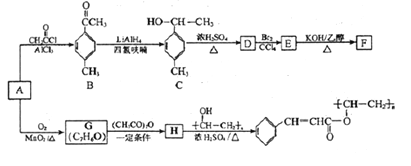
(1)A的分子式为__________,C中的官能团名称为________________。
(2)D分子中最多有______个原子共平面。
(3)E生成F的反应类型为___________,G的结构简式为__________。
(4)由H生成I的化学方程式为______________。
(5)符合下列条件的B的同分异构体有_______种(不考虑立体异构),其中核磁共振氢谱为4组峰,且面积比为6:2:1:1的是________(写出其中一种的结构简式)。
①属于芳香化合物; ②能发生银镜反应。
(6)已知![]() ,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备
,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备![]() 的合成路线________________。
的合成路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是 ( )
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是 ( )
A.加少量烧碱固体 B.加少量CH3COONa固体
C.加少量冰醋酸 D.加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 酯类物质是形成水果香味的主要成分
B. 可用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
C. 乙酸乙酯、油脂与烧碱溶液反应均有醇生成
D. 可向蔗糖的水解液中直接加入银氨溶液检验蔗糖是否发生水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.01molNH4Cl和0.005molNaOH溶于水配成1L溶液(pH>7).
(1)该溶液中存在的三个平衡体系是 、 、 。
(2)溶液中存在的离子物质的量浓度由大到小顺序为 。
(3)这些粒子中浓度为0.01mol/L的是 ,浓度为0.005mol/L的是 。
(4)物质的量之和为0.0lmol的二种粒子是 。
(5)NH4+和H+两种粒子物质的量之和比OH-多 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质按酸、碱、混合物、电解质的顺序组合的一组是
A. 氢氟酸、纯碱、空气、液氨
B. 硝酸、烧碱、水玻璃、硫酸钡
C. 醋酸、熟石灰,胆矾、小苏打
D. 硫酸、碱式碳酸铜、汽油、草木灰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com