
【题目】工业用强氧化剂PbO2来制备KClO4的工业流程如下:
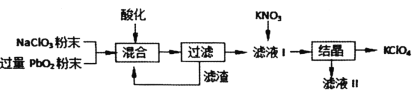
根据流程推测,下列判断不正确的是( )
A.“酸化”的试剂是稀硝酸或浓盐酸
B.“滤渣”主要成分是PbO2粉末,可循环使用
C.NaClO3与PbO2反应的离子方程式为![]()
D.在KNO3、KClO4、NaClO4、NaNO3中,常温下溶解度小的是KClO4
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。在一定温度下,用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的盐酸和醋酸溶液,滴定曲线如图所示。下列有关判断正确的是

A. B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+)
B. A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.1mol/L
C. C点水电离的c(OH-)大于A点水电离的c(OH-)
D. A、B、C三点溶液均有Kw=c(H+)·c(OH-)=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向25℃时,体积均为20mL浓度均为0.1mol·L-1的两种酸HX、HY溶液中分別滴加0.1mol·L-1的NaOH溶液所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是

A. HX、HY均为弱酸
B. Ka(HY)的数量级约为10-6
C. b点时:2c(Na+)=c(Y-)+c(HY)
D. V(NaOH)=20mL时,反应后的两种溶液中c(X-)=c(Y-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:COCl2(g) ![]() CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施中:①升温 ②恒 容通入惰性气体 ③增加 COCl2 浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高 COCl2 转化率的是
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施中:①升温 ②恒 容通入惰性气体 ③增加 COCl2 浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高 COCl2 转化率的是
A.①④B.①④⑥C.②③⑤D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.46 g C2H6O中含有的C-H键数一定为5NA
B.常温常压下,17g甲基(-14CH3)所含电子总数为9NA
C.标准状况下,11.2 L CO2和乙炔的混合气体所含![]() 键数目为NA
键数目为NA
D.CO2气体与足量的Na2O2反应,固体增重28g时转移了NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下,Ksp(CuS)=1.0×10-36,K sp(HgS)=1.6×10-52;pM=-lgc(M2+)。常温下,向10.0mL0.20mol·L-1Cu(NO3)2溶液中逐滴滴加0.10mo l·L-1Na2S溶液,溶液中pM与加入Na2S溶液的体积(V)的关系如图所示。下列说法错误的是

A. V0=20.0mL,m=18
B. 若c[Cu(NO3)2]=0.01mol·L-1,则反应终点可能为e点
C. a、b、d三点中,由水电离的c(H+)和c(OH-)的积最大的为b点
D. 相同条件下,若用等浓度等体积的Hg(NO3)2溶液代替上述Cu(NO3)2溶液,则反应终点b向c方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.01molL-1的NaOH溶液滴定20mL同浓度的HCN溶液,滴定曲线如图所示,下列说法正确的是( )

A. Ka(HCN)的数量级为10-8
B. 点①时,向溶液中滴入几滴1mol/L的HCN溶液,溶液中c(H+)/ c(HCN)的值增大
C. 点②时,溶液中微粒浓度大小关系:c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+)
D. 在标示的四种情况中,水的电离程度最大的是②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是化学实验室中最常见的有机物,它与水互溶并有特殊香味;B的产量可衡量一个国家石油化工发展的水平。有关物质的转化关系如图所示(反应条件没有全部注明),请回答:
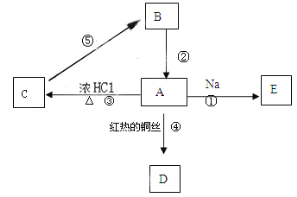
(1)有机物A的官能团名称是_______,该官能团的电子式是______。
(2)反应③的反应类型是________。
(3)反应④的化学方程式是_______。
(4)反应⑤的化学方程式是______。
(5)下列说法正确的是_______
A.反应①中Na与A的反应比Na与H2O反应更剧烈
B.反应⑤的反应类型是消去反应
C.有机物A可以使酸性高锰酸钾褪色
D.有机物B不能发生加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
Fe2O3(s)+1/3CO(g)=2/3Fe3O4(s)+1/3CO2(g) ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe单质和CO2气体时对应的ΔH约为( )
A.-218 kJ/molB.-109 kJ/molC.+109 kJ/molD.+218 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com