
- 4 |
| c(H2C2O4) | ||
c(HC2
|
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
- 4 |
| c(H+)?c(HC2O4-) |
| c(H2C2O4) |
| c(H2C2O4)?c(OH-) | ||
c(HC2
|
| Kw |
| Ka |
| 1×10-14 |
| 5×10-2 |
| c(H2C2O4) | ||
c(HC2
|


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
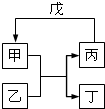 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图5所示转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图5所示转化关系的是( )| 甲 | 乙 | 丙 | 戊 | |
| ① | NH3 | O2 | NO2 | H2 |
| ② | Fe | H2O | Fe3O4 | Al |
| ③ | Al2O3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| ④ | Na2O2 | CO2 | O2 | Na |
| A、①③ | B、②③ | C、②④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,FeS的溶解度大于MnS的溶解度 |
| B、25℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36 mol?L-1 |
| C、除去某溶液中的Cu2+,可以选用FeS或MnS作沉淀剂 |
| D、因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
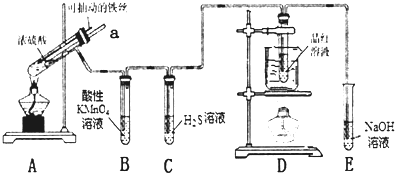
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+和Cl- |
| B、H+和CO32- |
| C、H+和Cl- |
| D、Na+和SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验剩余的钠可放入废液缸中 |
| B、用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 |
| C、大量氯气泄漏时,迅速离开现场,并逆风前往安全区域疏散 |
| D、不慎洒出的酒精在桌上着火时,立即用大量水扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“天宫一号”中使用的碳纤维,是一种新型无机非金属材料 |
| B、为防止富脂食品氧化变质,常在包装袋中放入生石灰 |
| C、开发新能源,减少对化石燃料的依赖,可以促进低碳经济 |
| D、“静电除尘”、“燃烧固硫”、“汽车尾气催化净化”都能提高空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X、W、U的最高价氧化物对应的水化物酸性由强到弱的顺序为:U>W>X |
| B、Y、Z元素的单质作电极,在NaOH溶液中构成原电池,Z电极上产生大量气泡 |
| C、室温下,0.05 mol/L U的气态氢化物的水溶液的pH>1 |
| D、Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com