
【题目】回归、改进、拓展教材实验,是高考化学实验考查的常见形式。
I.甲组同学在进行《必修二》实验2-5“Fe3+离子在H2O2溶液分解实验中的催化作用”时,进行了以下探究。基于目前学过的元素周期表的相关知识,该小组推测了同为第四周期第VIII族的Fe、Co、Ni可能有相似的催化机理。
【查阅资料】:钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。其中CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性。
(1)写出H2O2溶液在Fe3+催化下分解的化学方程式__________________________________。
(2)①该催化剂中铁元素的化合价为 。
②下图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知: 法制取得到的催化剂活性更高,由此推测Co2+、Ni2+两种离子中催化效果更好的是 。

II.乙组同学在进行《选修四》实验2-2“草酸溶液浓度对酸性高锰酸钾溶液褪色时间的影响”时,发现溶液褪色总是先慢后快,该小组设计了如下过程探究其原因:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为(流程中“III”等为Mn的价态):
![]()
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+ 对该反应有催化作用
假设3:K+ 对该反应有催化作用
【设计、完成实验】
(3)称取 g草酸晶体(H2C2O4·2H2O),配制500 mL 0.10 mol/L H2C2O4溶液。在上述过程中必须用到的2种定量仪器是托盘天平和
(4)完成探究,记录数据
实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
0.10 mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50 mol/L 稀硫酸 | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | 水浴控制温度65 ℃ | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
4 | 30 | 20 | x | 20 | 加入5 mL 0.10 mol/L K2SO4溶液 | 18 |
仔细阅读分析表中数据,回答问题:
x = mL,假设__________成立(填“1” 、“2”或“3”)
【答案】(1)2H2O2 ![]() 2H2O + O2↑
2H2O + O2↑
(2)①+3价 ② 微波加热 Co2+ (3)6.3 g 500 mL 容量瓶 (4)25 2
【解析】
试题分析:(1)H2O2溶液在Fe3+催化下分解生成水和氧气,反应的化学方程式为2H2O2 ![]() 2H2O + O2↑。
2H2O + O2↑。
(2)①根据化合价代数和为0计算Fe的化合价,CoxNi(1-x)Fe2O4中Co、Ni均为+2,O为-2价,则Fe的化合价为4×2-(2x+2-2x)÷2=+3;
②过氧化氢的分解速率越大,催化剂活性越高,根据图象可知,x相同时,微波水热法初始速度大于常规水热法,所以微波水热法制得催化剂的活性更高;由图可知,随x值越大,过氧化氢的分解速率越大,而x增大,Co2+的比例增大,所以Co2+的催化活性更高。
(3)(1)n(H2C2O4)= 0.5L ×0.10mol/L=0.05mol,所以m(H2C2O4·2H2O)= 0.05mol×126g/mol=6.3g,因此要称取6.3g草酸晶体(H2C2O4·2H2O),来配制500mL 0.10mol/L H2C2O4溶液;因为要称量6.3g固体物质,要配制500mL溶液,所以在上述过程中必须用到的2种定量仪器是托盘天平和500ml容量瓶。
(4)根据表格数据可知:4与3不同之处就是4中含有一定量的K2SO4溶液,其它都应该相同,忽略溶液的体积变化,则x应该是加入25ml的水;根据1、2可知温度对溶液的褪色时间影响并不大,说明假设1不成立;根据1、3可知当溶液中含有少量的Mn2+时反应速率大大加快,说明Mn2+对该反应影响大,是反应的催化剂,假设2成立;根据1、4比较可知K+对该反应无影响,假设3错误。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是:
A.在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解
B.Fe(OH)3胶体无色、透明,能发生丁达尔现象
C.H2、SO2、CO2三种气体都可用浓硫酸干燥
D.SiO2既能和氢氧化钠溶液反应有能和氢氟酸反应,所以是两性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸二乙酯(D)可由石油气裂解得到的烯烃合成.回答下列问题:
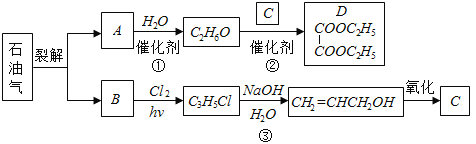
(1)B和A为同系物,B的结构简式为 .
(2)反应①的化学方程式为 ,其反应类型为 .
(3)反应③的反应类型为 .
(4)C的结构简式为 .
(5)反应②的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用如图装置进行中和热的测定,请回答下列问题:
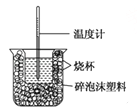
(1)图示装置有两处重要组成部分未画出,它们是 、 。
(2)烧杯间填满碎泡沫塑料的作用是 。
(3)若操作时分几次注入反应液,求得的反应热数值 (填“偏大”“偏小”或“无影响”)。
(4)做一次完整的中和热测定实验,温度计需使用 次。
(5)量取0.5mol/L的盐酸和0.55mol/L的NaOH溶液各50 mL进行实验,测得盐酸和NaOH溶液起始平均温度为t1℃,混合反应后最高温度为t2℃,设溶液密度均为1 g/mL,生成溶液的比热容c = 4.18 J/g℃。请列式计算中和热:△H= kJ/mol(不用化简)。
(6)已知:HCl(aq)+NaOH(aq)===NaCl(aq)+H2O(l) △H1= a kJ/mol
HCl(aq)+NH3H2O(aq)===NH4Cl(aq)+H2O(l) △H2= b kJ/mol
则NH3H2O(aq)![]() NH4+(aq)+ OH-(aq) △H3= ________ kJ/mol(用a、b表示)
NH4+(aq)+ OH-(aq) △H3= ________ kJ/mol(用a、b表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将羧酸的碱金属盐电解可生成烃类化合物,例如
2CH3COOK+2H2O=CH3—CH3↑+2CO2↑+H2↑+2KOH
现充分电解CH2ClCOOK水溶液,并加热电解后的水溶液,则下列说法中合理的是( )
A.CO2气体在阴极放出
B.加热后有不溶于水的油状物生成
C.混合液蒸干后得到的固体物质是KOH
D.混合液蒸干后得到的固体物质是KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海藻灰中可以提取碘的主要反应为:2 I-+Cl2=2 Cl-+I2,下列说法正确的是)( )
A.该反应属于置换反应 B.I-具有氧化性
C.1mol氯气转移了1mol电子 D.Cl2是还原剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com