
| A. | [PtCl4]2- | B. | [Zn(NH3)4]2+ | C. | [Ni(CN)4]2- | D. | [Cu(H2O)4]2+ |
分析 根据中心原子价层电子对互斥理论确定其空间构型,中心原子含有4个价层电子对,而且不含有孤电子对的分子为正四面体.
解答 解:A.Pt2+中核外电子排布式为【Xe】4f14 5d8,[PtCl4]2-的d轨道参与杂化,为dsp2杂化,为平面正方形,故A错误;
B.锌离子核外电子排布式为:1s22s22p63s23p63d10,[[Zn(NH3)4]2+中Zn2+ 离子的3d10,即d亚层全充满,为了接受配位电子,Zn2+ 离子只有动用s和p亚层,sp3杂化,结构为正四面体,结构为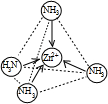 ,故B正确;
,故B正确;
C.Ni 2+的核外电子排布式为1s22s22p63s23p63d8,[Ni(CN)4]2-中心Ni 2+ 采用dsp2杂化轨道成键,配离子呈平面正方形,故C错误;
D.铜离子核外电子排布式为1s22s22p63s23p63d9,[Cu(H2O)4]2+中心Cu2+离子是sp3d2杂化,是平面正方形,故D错误;
故选B.
点评 本题主要考查了价层电子对互斥理论的运用,侧重配位键的轨道杂化类型考查,题目难度中等,注意把握孤电子对数的计算法.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | a |
| c(CO2) | 3 | 1 | 0.8 | 1 |
| c(H2) | 2 | 1 | 0.8 | 1 |
| c(CO) | 1 | 2 | 3 | 0.5 |
| c(H2O) | 2 | 2 | 3 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸中加入冰醋酸,醋酸电离平衡右移,电离度增大 | |
| B. | 向NaF溶液中滴加硫酸至中性时,c(SO42-)<c(HF) | |
| C. | 向氨水中加入NH4C1固体,溶液中$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$增大 | |
| D. | AgCl在水和NaCl溶液中的溶度积分别为K1、K2,则K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将lmol H2和1molCl2光照或点燃后的产物 | |
| B. | 6.02×1023个HCl气体分子 | |
| C. | 室温下,将1molHCl气体通入100mL水中所得溶液 | |
| D. | 室温下,73gHCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠(碳酸氢钠):加热,直到质量不再减少为止 | |
| B. | 溴苯(溴):加入氢氧化钠溶液洗涤,分液 | |
| C. | 乙醇(乙醛):加入新制氢氧化铜煮沸,过滤 | |
| D. | 乙酸丁酯(乙酸):加入碳酸钠溶液洗涤,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
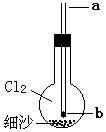 如图烧瓶内充满氯气,底部有层细沙(不参与反应),b处塞有小块钠.从a口用细铁丝把钠送下去,再从a口滴下一滴水,恰好滴在钠块上,立即剧烈反应,烧瓶内产生大量白色烟雾.不正确的说法是( )
如图烧瓶内充满氯气,底部有层细沙(不参与反应),b处塞有小块钠.从a口用细铁丝把钠送下去,再从a口滴下一滴水,恰好滴在钠块上,立即剧烈反应,烧瓶内产生大量白色烟雾.不正确的说法是( )| A. | 水可能参与二个氧化还原反应 | |
| B. | Cl2可能参与四个氧化还原反应 | |
| C. | 氧元素参与的反应一定是氧化还原反应 | |
| D. | 氢元素参与的反应包含被氧化与被还原过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com