
【题目】下列指定反应的离子方程式正确的是( )
A. 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-
B. 室温下用稀HNO3溶解铜:Cu+2![]() +2H+=Cu2++2NO2↑+H2O
+2H+=Cu2++2NO2↑+H2O
C. 用Na2S2O3溶液吸收水中的Cl2:4Cl2+S2O32—+5H2O=10H++2SO42—+8Cl-
D. 向NaAlO2溶液中通入过量CO2:2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32—
【答案】C
【解析】
A项、酸性条件下,过氧化氢与海带灰浸出液中的碘离子反应生成单质碘和水,反应的离子方程式为2I-+H2O2+2H+=I2+2H2O,故A错误;
B项、稀HNO3与铜反应生成硝酸铜、一氧化氮和水,反应的离子方程式为3Cu+2NO3—+8H+=3Cu2++2NO↑+4H2O,故B错误;
C项、Na2S2O3溶液与Cl2反应生成硫酸和盐酸,反应的离子方程式为4Cl2+S2O32—+5H2O=10H++2SO42—+8Cl-,故C正确;
D项、NaAlO2溶液中与过量的CO2反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为AlO2—+CO2+2H2O=Al(OH)3↓+HCO3—,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al混合物投入到200mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是( )
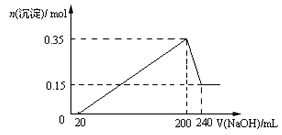
A. Mg和Al的总质量为9g
B. 最初20mLNaOH溶液用于中和过量的稀硫酸
C. NaOH溶液物质的量浓度为5mol·L-1
D. 生成的氢气在标准状况下的体积为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧生成SO2气体,放出的热量一样多
B.由C(石墨)=C(金刚石) ΔH=+1.90kJ·mol-1可知,金刚石比石墨稳定
C.2CO(g)+O2(g)=2CO2(g) ΔH<0,则56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量
D.已知:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1,则相同条件下,在密闭容器中,1molN2和3molH2混合充分反应后放出92.4kJ的热量
2NH3(g) ΔH=-92.4kJ·mol-1,则相同条件下,在密闭容器中,1molN2和3molH2混合充分反应后放出92.4kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是一种香料,其合成路线如下:
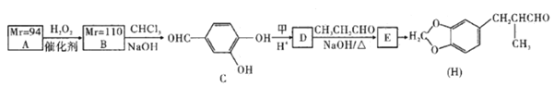
已知: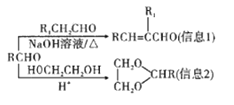
回答下列问题:
(1)A遇氯化铁溶液发生显色反应且A仅含C、H、0三种元素,则A的名称是________。
(2)甲的相对分子质量为30,下列有关甲的说法正确的是______(填字母)。
a.常温下,甲能使溴水(或酸性高锰酸钾溶液)褪色
b. 1 mol甲与足量银氨溶液反应最多生成2 mol Ag
c.甲和葡萄糖的最简式相同
d.甲在常温常压下呈液态
(3)写出A—B反应的原子利用率的表达式为_________________________________。
(4)在一定条件下,甲和A合成电木的化学方程式为_______________________。
(5)参照上述信息,以苯甲醇和乙醛为原料合成肉桂酸(![]() ),设计合成路线:___(无机试剂任用,合成路线流程图示例见本题题干)。
),设计合成路线:___(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4L己烷中含有分子数目为NA
B. 1mol/LNaOH溶液中含有Na+数目为NA
C. 7.8gNa2O2中含有的共价键数目为0.1NA
D. 将0.5molN2O4充入密闭容器中充分反应转化成NO2的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列判断正确的是( )
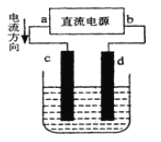
A.a为负极、b为正极
B.电解过程中,c电极上发生氧化反应
C.d为阳极,电极反应为:2Cl--2e-=Cl2↑
D.电解过程中,电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已经学过的化学知识,回答下列问题。
I.(1)现有下列十种物质:①蔗糖 ②熔融KNO3 ③石墨 ④铜丝 ⑤NaOH固体 ⑥SO3 ⑦BaSO4固体 ⑧K2O固体 ⑨液态H2SO4 ⑩液氯 上述物质中可导电的是____________(填序号,下同);上述物质中不能导电,但属于电解质的是_______________________。
(2)NaHSO4是一种酸式盐,请填写下列空白:
①写出NaHSO4在水中的电离方程式____________________________________。
②与0.1 mol·L—1的NaHSO4溶液的导电能力相同的硫酸钠溶液的物质的量浓度为:_____。
③NaHSO4溶液与NaHCO3溶液反应的离子方程式为______________________________。
(3)粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,除去这些杂质的试剂可选用,①Na2CO3、②NaOH、③BaCl2、④HCl,用序号表示加入的先后顺序依次是_________。
II.A、B、C、X均为中学常见物质,它们在一定条件下有如下转化关系(副产物已略去)。
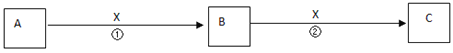
(1)若X是氧气,则A不可能 ______(填序号)
A.C B.SiC.NaD.Mg
(2)若X是金属单质,向浅绿色溶液C中滴入AgNO3溶液,产生了不溶于稀HNO3的白色沉淀,则B的化学式为__________;C溶液在贮存时应加入少量X,理由是(用离子方程式表示)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
实验室用干燥、纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:

(1)仪器A冷却水的进水口为________(填“a”或“b”)。
(2)仪器B中盛放的药品是________,其目的是________________________。
(3)实验时,装置丁中发生反应的离子方程式为______________________________,当生成6.72L的氯气(标况下),转移电子的物质的量为________。
(4)装置丙中盛放的试剂是________,若缺少装置乙,对实验造成的影响是_______________。
(5)少量硫酰氯也可用液态氯磺酸(ClSO3H)低温催化分解获得,该反应的化学方程式为:2ClSO3H=H2SO4 +SO2Cl2,从分解产物中分离出硫酰氯的操作是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com