
【题目】根据已经学过的化学知识,回答下列问题。
I.(1)现有下列十种物质:①蔗糖 ②熔融KNO3 ③石墨 ④铜丝 ⑤NaOH固体 ⑥SO3 ⑦BaSO4固体 ⑧K2O固体 ⑨液态H2SO4 ⑩液氯 上述物质中可导电的是____________(填序号,下同);上述物质中不能导电,但属于电解质的是_______________________。
(2)NaHSO4是一种酸式盐,请填写下列空白:
①写出NaHSO4在水中的电离方程式____________________________________。
②与0.1 mol·L—1的NaHSO4溶液的导电能力相同的硫酸钠溶液的物质的量浓度为:_____。
③NaHSO4溶液与NaHCO3溶液反应的离子方程式为______________________________。
(3)粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,除去这些杂质的试剂可选用,①Na2CO3、②NaOH、③BaCl2、④HCl,用序号表示加入的先后顺序依次是_________。
II.A、B、C、X均为中学常见物质,它们在一定条件下有如下转化关系(副产物已略去)。
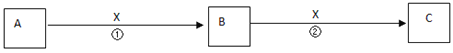
(1)若X是氧气,则A不可能 ______(填序号)
A.C B.SiC.NaD.Mg
(2)若X是金属单质,向浅绿色溶液C中滴入AgNO3溶液,产生了不溶于稀HNO3的白色沉淀,则B的化学式为__________;C溶液在贮存时应加入少量X,理由是(用离子方程式表示)________________。
【答案】②③④ ⑤⑦⑧⑨ NaHSO4 = Na++H++ SO42— 0.1mol/L H++HCO3—= H2O+CO2↑ ②③①④或③②①④ B D FeCl3 2Fe3++Fe=3Fe2+
【解析】
I.(1) 存在自由移动的带电微粒即可导电;在水溶液中或熔化状态下能导电的化合物属于电解质;
(2)NaHSO4是一种酸式盐,在水溶液中电离出钠离子、氢离子和硫酸根离子;溶液的导电能力相同说明两溶液的离子浓度相同;NaHSO4溶液与NaHCO3溶液反应生成硫酸钠、二氧化碳和水;
(3)加入过量的氯化钡溶液,可以将硫酸盐除去,但是会引入钡离子;加入过量氢氧化钠溶液,可以除去氯化镁,但是会引入氢氧根离子;加入过量的碳酸钠溶液,可以除去CaCl2和过量的BaCl2,但是会引入碳酸根离子;过滤,将得到的沉淀全部滤出,得到的滤液是含有氯化钠、碳酸钠、氢氧化钠等的混合物,加入足量的盐酸,可以出去碳酸根离子、氢氧根离子,最后即可获得较为纯净的氯化钠溶液;
II.(1)若X为O2,A能连续被氧化,则A、B、C中含有的同种元素为变价元素;
(2)若X是金属单质,说明X元素为变价金属。
I.(1) ①蔗糖属于非电解质,不能导电;②熔融KNO3属于电解质,有自由移动的离子,能导电;③石墨是单质,既不是电解质也不是非电解质,能导电;④铜丝是单质,既不是电解质也不是非电解质,能导电;⑤NaOH固体属于电解质,没有自由移动的离子,不能导电;⑥SO3属于非电解质,不能导电;⑦BaSO4固体属于电解质,没有自由移动的离子,不能导电;⑧K2O固体属于电解质,没有自由移动的离子,不能导电;⑨液态H2SO4属于电解质,没有自由移动的离子,不能导电;⑩液氯是单质,既不是电解质也不是非电解质,不能导电,则可导电的是②③④;不能导电,但属于电解质的是⑤⑦⑧⑨,故答案为:②③④;⑤⑦⑧⑨;
(2) ①NaHSO4是一种酸式盐,在水溶液中电离出钠离子、氢离子和硫酸根离子,电离方程式为NaHSO4=Na++H++SO42—,故答案为:NaHSO4 =Na++H++ SO42—;
②导电能力与离子浓度成正比,溶液的导电能力相同说明两溶液的离子浓度相同,则硫酸钠溶液的物质的量浓度为0.1 mol·L—1,故答案为:0.1 mol·L—1;
③NaHSO4是强酸的酸式盐,NaHCO3是弱酸的酸式盐,NaHSO4溶液与NaHCO3溶液反应生成硫酸钠、二氧化碳和水,反应的离子方程式为H++HCO3—=H2O+CO2↑,故答案为:H++HCO3—=H2O+CO2↑;
(3)粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,加入过量的氯化钡溶液,可以将硫酸盐除去,但是会引入钡离子;加入过量氢氧化钠溶液,可以除去氯化镁,但是会引入氢氧根离子;加入过量的碳酸钠溶液,可以除去CaCl2和过量的BaCl2,但是会引入碳酸根离子;过滤,将得到的沉淀全部滤出,得到的滤液是含有氯化钠、碳酸钠、氢氧化钠等的混合物,加入足量的盐酸,可以出去碳酸根离子、氢氧根离子,最后即可获得较为纯净的氯化钠溶液,则加入试剂的先后顺序是②③①④或③②①④,故答案为②③①④或③②①④;
II.(1)若X为O2,A能连续被氧化,则A、B、C中含有的同种元素为变价元素,该元素可能为C元素,C单质在氧气中不完全燃烧生成一氧化碳,一氧化碳在氧气中燃烧生成二氧化碳;也可能为Na元素,Na单质在空气中放置生成氧化钠,氧化钠在氧气中加热生成过氧化钠,而硅高温条件下与氧气反应只能生成二氧化硅,镁在氧气中燃烧只能生成氧化镁,故答案为:BD;
(2)向浅绿色溶液C中滴入AgNO3溶液,产生了不溶于稀HNO3的白色沉淀,说明C为氯化亚铁溶液,单质X为铁,A为氯气,B为氯化铁,铁在氯气中燃烧生成氯化铁,氯化铁溶液与铁反应生成氯化亚铁,反应的化学方程式为2Fe3++Fe=3Fe2+,故答案为:FeCl3;2Fe3++Fe=3Fe2+。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是
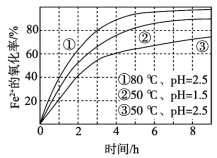
A. Fe2+的氧化率随时间延长而逐渐增大
B. 由②和③可知,pH越大,Fe2+氧化速率越快
C. 由①和③可知,温度越高,Fe2+氧化速率越快
D. 氧化过程的离子方程式为:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-
B. 室温下用稀HNO3溶解铜:Cu+2![]() +2H+=Cu2++2NO2↑+H2O
+2H+=Cu2++2NO2↑+H2O
C. 用Na2S2O3溶液吸收水中的Cl2:4Cl2+S2O32—+5H2O=10H++2SO42—+8Cl-
D. 向NaAlO2溶液中通入过量CO2:2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数。下列说法正确的是( )
A. 1mol月球背面的氦—3(3He)含有质子为2NA
B. 标况下,22.4L甲烷和1molCl2反应后的混合物中含有氯原子数小于2NA
C. 2molSO2与1molO2充分反应,转移的电子数为4NA
D. 25℃时,1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示转化关系(X代表卤素),说法不正确的是
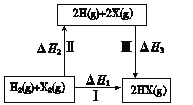
A.2H(g) +2X(g) = 2HX(g) ΔH3<0
B.途径Ⅰ生成HX的反应热与途径无关,所以ΔH1 = ΔH2 + ΔH3
C.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
D.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2广泛用于医药、硫酸工业等领域,回收废气中的SO2可用如下方法。
方法Ⅰ | 用碱式硫酸铝Al2(SO4)x(OH)y溶液吸收富集SO2 |
方法Ⅱ | 在Fe2+或Fe3+催化下,用空气(O2)将SO2氧化为H2SO4 |
(1)方法Ⅰ的过程如下。
① 制备Al2(SO4)x(OH)y。向Al2(SO4)3溶液中加入CaO粉末,调pH至3.6。 CaO的作用是______
② 吸收:Al2(SO4)x(OH)y吸收SO2后的产物是______(写化学式)。
③ 解吸:加热②中产物,产生SO2,Al2(SO4)x(OH)y再生。
(2)方法Ⅱ中,在Fe2+催化下,SO2、O2和H2O生成H2SO4的化学方程式是______。
(3)方法Ⅱ中,Fe2+的催化过程可表示如下:
ⅰ:2Fe2++O2+SO2=2Fe3++SO42-
ⅱ:……
① 写出ⅱ的离子方程式:______。
② 下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向FeCl2溶液滴入KSCN,无变化
b.向FeCl2溶液通入少量SO2,滴入KSCN,颜色变红。
c.取b中溶液,______。
(4)方法Ⅱ中,催化氧化后,采用滴定法测定废气中残留SO2的含量。将V L(已换算为标准状况)废气中的SO2用1%的H2O2完全吸收,吸收液用如图所示装置滴定,共消耗a mL c mol/L NaOH标准液。

①H2O2氧化SO2的化学方程式______。
② 废气中残留SO2的体积分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方案设计能达到实验目的的是
A | B | C | D |
检验淀粉是否水解 | 由褪色快慢研究反应物浓度对反应速率的影响 | 证明发生了取代反应 | 验证Ksp[Cu(OH)2]<Ksp[Mg(OH)2 ] |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)乙基叔丁基醚(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂。用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应的化学方程式为:C2H5OH(g)+IB(g)=ETBE(g) △H。回答下列问题:
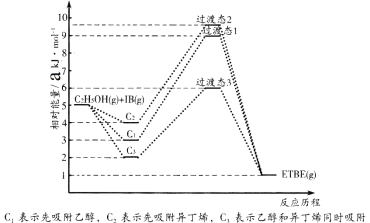
反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图所示,该反应的△H=__________ kJ·mol-1。反应历程的最优途径是________(填C1、C2或C3)。
(2)开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
反应ⅰ:CO(g)+2H2(g)CH3OH(g) ΔH1=-99kJ·mol1
反应ⅱ:2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol1
反应ⅲ:CO(g)+H2O(g)CO2(g)+H2(g) ΔH3=-41.2kJ·mol1
①在该条件下,若反应1的起始浓度分别为:c(CO)=0.6mol·L1,c(H2)=1.4mol·L1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为__________。
②在t℃时,反应2的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c(mol·L1) | 0.46 | 1.0 | 1.0 |
此时刻v正___v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是___。
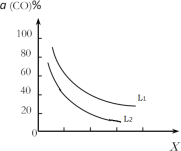
③催化反应室的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示,图中X代表___(填“温度”或“压强”),且L1___L2(填“>”“<”或“=”)。
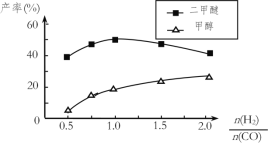
④在催化剂的作用下同时进行三个反应,发现随着起始投料比![]() 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:______________。
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是 ( )

A.通电后中间隔室的SO42-向阳极迁移,阳极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.阴极反应为4OH--4e-=O2↑+2H2O,阴极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有11.2L O2生成(标况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com