
【题目】下列方案设计能达到实验目的的是
A | B | C | D |
检验淀粉是否水解 | 由褪色快慢研究反应物浓度对反应速率的影响 | 证明发生了取代反应 | 验证Ksp[Cu(OH)2]<Ksp[Mg(OH)2 ] |
|
|
|
|
A.AB.BC.CD.D
【答案】A
【解析】
A、淀粉水解时要用硫酸作催化剂,要先用NaOH将混合液中和至弱碱性或中性,再用新制氢氧化铜悬浊液检验,故A正确;
B、实验的原理方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,题中高锰酸钾过量,应设计成:高锰酸钾的物质的量相同,浓度不同的草酸溶液,且草酸要过量,探究反应物浓度对该反应速率的影响,故B错误;
C、要证明甲烷与氯气发生了取代反应,因有氯化氢生成,不能通过体积变化就断定发生取代反应,故C错误;
D、验证Ksp[Cu(OH)2]<Ksp[Mg(OH)2 ],要先制得Mg(OH)2,再加入少量Cu2+,沉淀转化为Cu(OH)2,沉淀由白色转化成蓝色,故D错误;
故选A。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列判断正确的是( )
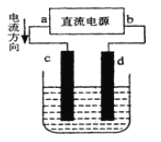
A.a为负极、b为正极
B.电解过程中,c电极上发生氧化反应
C.d为阳极,电极反应为:2Cl--2e-=Cl2↑
D.电解过程中,电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已经学过的化学知识,回答下列问题。
I.(1)现有下列十种物质:①蔗糖 ②熔融KNO3 ③石墨 ④铜丝 ⑤NaOH固体 ⑥SO3 ⑦BaSO4固体 ⑧K2O固体 ⑨液态H2SO4 ⑩液氯 上述物质中可导电的是____________(填序号,下同);上述物质中不能导电,但属于电解质的是_______________________。
(2)NaHSO4是一种酸式盐,请填写下列空白:
①写出NaHSO4在水中的电离方程式____________________________________。
②与0.1 mol·L—1的NaHSO4溶液的导电能力相同的硫酸钠溶液的物质的量浓度为:_____。
③NaHSO4溶液与NaHCO3溶液反应的离子方程式为______________________________。
(3)粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,除去这些杂质的试剂可选用,①Na2CO3、②NaOH、③BaCl2、④HCl,用序号表示加入的先后顺序依次是_________。
II.A、B、C、X均为中学常见物质,它们在一定条件下有如下转化关系(副产物已略去)。
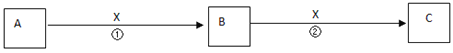
(1)若X是氧气,则A不可能 ______(填序号)
A.C B.SiC.NaD.Mg
(2)若X是金属单质,向浅绿色溶液C中滴入AgNO3溶液,产生了不溶于稀HNO3的白色沉淀,则B的化学式为__________;C溶液在贮存时应加入少量X,理由是(用离子方程式表示)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为“铁链环”结构,图中两环相交部分A、B、C、D 表示物质间的反应。下列对应部分反应的离子方程式书写不正确的是
![]()
A.Cl2+2OH-=Cl-+ClO-+H2O
B.Cu2++2OH-=Cu(OH)2↓
C.Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓
D.OH-+HCO3-=H2O+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 W、X、Y、Z 的原子序数逐渐增大,四种元素形成的化合物甲的结构如图所示。且 W 与 X、Y、Z 均可形成电子数相等的分子,W2Z常温常压下为液体。下列说法正确的是
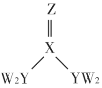
A.YW3 分子中的键角为120°
B.W2Z 的稳定性大于YW3
C.1mol甲分子中存在2mol Y-W键
D.Y 元素的氧化物对应的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,电流计指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C可能是下列各组中的

A.A是Ag,B是Fe,C为稀AgNO3溶液
B.A是Cu,B是Zn,C为稀H2SO4
C.A是Fe,B是Ag,C为稀AgNO3溶液
D.A是Zn,B是Cu,C为稀H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
实验室用干燥、纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:

(1)仪器A冷却水的进水口为________(填“a”或“b”)。
(2)仪器B中盛放的药品是________,其目的是________________________。
(3)实验时,装置丁中发生反应的离子方程式为______________________________,当生成6.72L的氯气(标况下),转移电子的物质的量为________。
(4)装置丙中盛放的试剂是________,若缺少装置乙,对实验造成的影响是_______________。
(5)少量硫酰氯也可用液态氯磺酸(ClSO3H)低温催化分解获得,该反应的化学方程式为:2ClSO3H=H2SO4 +SO2Cl2,从分解产物中分离出硫酰氯的操作是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体,图 1 表示各物质浓度随时间的变化,图 2 表示速率随时间的变化,t2、t3、t4、t5 时刻各改变一种条件,且改变的条件均不同。若t4时刻 改变的条件是压强,则下列说法错误的是

A.若 t1=15 s,则前 15 s 的平均反应速率 v(C)=0.004 mol·L-1·s-1
B.该反应的化学方程式为 3A(g)![]() B(g)+2C(g)
B(g)+2C(g)
C.t2、t3、t5 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D.若 t1=15 s,则 B 的起始物质的量为 0.04 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com