
【题目】SO2广泛用于医药、硫酸工业等领域,回收废气中的SO2可用如下方法。
方法Ⅰ | 用碱式硫酸铝Al2(SO4)x(OH)y溶液吸收富集SO2 |
方法Ⅱ | 在Fe2+或Fe3+催化下,用空气(O2)将SO2氧化为H2SO4 |
(1)方法Ⅰ的过程如下。
① 制备Al2(SO4)x(OH)y。向Al2(SO4)3溶液中加入CaO粉末,调pH至3.6。 CaO的作用是______
② 吸收:Al2(SO4)x(OH)y吸收SO2后的产物是______(写化学式)。
③ 解吸:加热②中产物,产生SO2,Al2(SO4)x(OH)y再生。
(2)方法Ⅱ中,在Fe2+催化下,SO2、O2和H2O生成H2SO4的化学方程式是______。
(3)方法Ⅱ中,Fe2+的催化过程可表示如下:
ⅰ:2Fe2++O2+SO2=2Fe3++SO42-
ⅱ:……
① 写出ⅱ的离子方程式:______。
② 下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向FeCl2溶液滴入KSCN,无变化
b.向FeCl2溶液通入少量SO2,滴入KSCN,颜色变红。
c.取b中溶液,______。
(4)方法Ⅱ中,催化氧化后,采用滴定法测定废气中残留SO2的含量。将V L(已换算为标准状况)废气中的SO2用1%的H2O2完全吸收,吸收液用如图所示装置滴定,共消耗a mL c mol/L NaOH标准液。

①H2O2氧化SO2的化学方程式______。
② 废气中残留SO2的体积分数为______。
【答案】CaO与水反应放出大量热且生成的OH-均促进Al3+的水解,同时Ca2+与SO42-生成微溶物控制溶液中的SO42-的量 ![]() 2SO2+O2+2H2O
2SO2+O2+2H2O![]() 2H2SO4
2H2SO4 ![]() 通入SO2,溶液红色褪去(或变浅) SO2+H2O2=H2SO4
通入SO2,溶液红色褪去(或变浅) SO2+H2O2=H2SO4 ![]()
【解析】
(1)①氧化钙可以和水反应生成氢氧化钙,同时产生大量的热,水解反应为吸热反应;要生成碱式硫酸铝需要控制硫酸根的量,而硫酸钙微溶;
②SO2与OH-按照1:2反应;
(3)①由于Fe2+作催化剂,所以反应ii中要使用亚铁离子的再生;
②铁元素的存在形式为Fe2+→Fe3+→Fe2+;
(4)该滴定原理为:先用双氧水氧化二氧化硫生成硫酸,再用NaOH标准液滴定硫酸的量,从而确定二氧化硫的量。
(1)①CaO溶于水生成Ca(OH)2,生成了氢氧根离子,同时放热大量的热,促进Al3+的水解;生成的钙离子结合SO42-生成硫酸钙,可沉淀部分SO42-,以控制溶液中硫酸根的量;
②SO2与OH-按照1:2反应生成SO32-,则Al2(SO4)x(OH)y吸收SO2后的产物是![]() ;
;
(2)根据元素化合价变化可知该过程中氧气氧化二氧化硫生成硫酸,结合电子守恒和元素守恒可得方程式为:2SO2+O2+2H2O![]() 2H2SO4;
2H2SO4;
(3)①由于Fe2+作催化剂,则ⅱ中Fe3+与SO2反应生成Fe2+,实现Fe2+的再生,则ⅱ的离子方程式为2Fe3++2H2O+SO2=2Fe2++4H++SO42-;
②根据反应ⅰ:2Fe2++O2+SO2=2Fe3++SO42-可知,向FeCl2溶液通入少量SO2,有铁离子生成,滴入KSCN后颜色变红,继续通入SO2,发生反应ⅱ:2Fe3++2H2O+SO2=2Fe2++4H++SO42-,溶液红色褪去(或变浅);
(4)①H2O2氧化SO2生成硫酸,根据电子守恒和元素守恒可得化学方程式为SO2+H2O2=H2SO4;
②根据关系式:SO2~H2SO4~2NaOH,n(SO2)=![]() n(NaOH)=
n(NaOH)=![]() cmol/L×a×10-3L=5ac×10-4mol,标况下5ac×10-4mol SO2的体积为:22.4L/mol×5ac×10-4mol=1.12×10-2ac L,所以废气中残留SO2的体积分数为:
cmol/L×a×10-3L=5ac×10-4mol,标况下5ac×10-4mol SO2的体积为:22.4L/mol×5ac×10-4mol=1.12×10-2ac L,所以废气中残留SO2的体积分数为:![]() 。
。


 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(![]() )。下列说法不正确的是
)。下列说法不正确的是
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
A. 反应①、②为反应③提供原料气
B. 反应③也是![]() 资源化利用的方法之一
资源化利用的方法之一
C. 反应![]() 的
的![]()
D. 反应![]() 的
的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4L己烷中含有分子数目为NA
B. 1mol/LNaOH溶液中含有Na+数目为NA
C. 7.8gNa2O2中含有的共价键数目为0.1NA
D. 将0.5molN2O4充入密闭容器中充分反应转化成NO2的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家成功实现甲烷在催化剂及无氧条件下,一步高效生产乙烯、芳香烃和氢气等化产品,为天然气化工开发了一条革命性技术。以甲烷为原料合成部分化工产品流程如图(部分反应条件已略去):

(1)E中官能团的名称为___,C物质的结构简式为___。
(2)上述③~⑥转化反应中,属于取代反应的有___(用反应序号填写)。
(3)写出反应⑦的反应方程式:__。
(4)实验室制备物质E时,装置如图所示(加热和夹持装置已省略)。试管a中实验前盛放的物质是___,实验后出现分层现象,分离物质D需要的玻璃仪器有___和烧杯等。

(5)某同学在试管b中加入6.0克乙酸和足量乙醇采用适当条件使反应充分进行,结束后在试管b回收到3.0克乙酸,则该同学在本次实验中制得乙酸乙酯的最大质量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已经学过的化学知识,回答下列问题。
I.(1)现有下列十种物质:①蔗糖 ②熔融KNO3 ③石墨 ④铜丝 ⑤NaOH固体 ⑥SO3 ⑦BaSO4固体 ⑧K2O固体 ⑨液态H2SO4 ⑩液氯 上述物质中可导电的是____________(填序号,下同);上述物质中不能导电,但属于电解质的是_______________________。
(2)NaHSO4是一种酸式盐,请填写下列空白:
①写出NaHSO4在水中的电离方程式____________________________________。
②与0.1 mol·L—1的NaHSO4溶液的导电能力相同的硫酸钠溶液的物质的量浓度为:_____。
③NaHSO4溶液与NaHCO3溶液反应的离子方程式为______________________________。
(3)粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,除去这些杂质的试剂可选用,①Na2CO3、②NaOH、③BaCl2、④HCl,用序号表示加入的先后顺序依次是_________。
II.A、B、C、X均为中学常见物质,它们在一定条件下有如下转化关系(副产物已略去)。
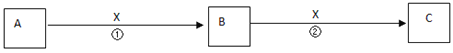
(1)若X是氧气,则A不可能 ______(填序号)
A.C B.SiC.NaD.Mg
(2)若X是金属单质,向浅绿色溶液C中滴入AgNO3溶液,产生了不溶于稀HNO3的白色沉淀,则B的化学式为__________;C溶液在贮存时应加入少量X,理由是(用离子方程式表示)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铁离子,氯气、溴均为常见的氧化剂,某化学兴趣小组设计了如下实验探究其强弱:
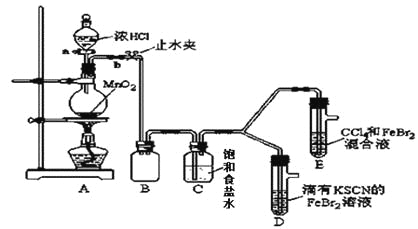
(1)①装置A中发生反应的离子方程式是_________________。
②整套实验装置存在一处明显的不足,请指出________。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后_______________。(填具体实验操作) | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。一段时间后______。(填实验现象) | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为:Cl2>Br2>Fe3+ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN-![]() Fe(SCN)3是一个可逆反应。
Fe(SCN)3是一个可逆反应。
ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2。
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因____。现设计简单实验证明上述解释:取少量褪色后的溶液,滴加________溶液,若溶液颜色______________。则上述解释是合理的。
小组同学另查得资料如下:
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
ⅳ.AgClO、AgBrO均可溶于水。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步离子方程式解释仅产生白色沉淀原因___________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 W、X、Y、Z 的原子序数逐渐增大,四种元素形成的化合物甲的结构如图所示。且 W 与 X、Y、Z 均可形成电子数相等的分子,W2Z常温常压下为液体。下列说法正确的是
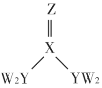
A.YW3 分子中的键角为120°
B.W2Z 的稳定性大于YW3
C.1mol甲分子中存在2mol Y-W键
D.Y 元素的氧化物对应的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯磺酸(HSO3Cl)在糖精、磺胺药的生产中有重要的应用。常温常压下氯磺酸为无色油状液体,沸点约为152℃,吸湿性和腐蚀性极强,在空气中发烟。学习小组在实验室用SO3和HCl来制备HSO3Cl并测定产品纯度。设计如下实验(夹持装置略去)。请回答下列问题:
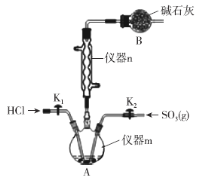
(1)仪器m的名称为___。
(2)已知:HSO3Cl中硫元素为+6价,O原子和Cl原子的最外层均满足8电子稳定结构,则HSO3Cl中的化学键为___ (填“离子键”、“极性键”或“非极性键”)。
(3)SO3可由五氧化二磷与浓硫酸共热制备,发生反应的化学方程式为___。
(4)装置B的作用为___。由仪器n可知制备HSO3Cl的反应为___ (填“放热反应”或“吸热反应”)。
(5)HSO3Cl纯度的测定(仪器m中得到的HSO3Cl中常溶有少量的SO3):
i.取25.0g产品溶于水中,加入过量的Ba(NO3)2溶液充分反应后,过滤。
ii.向滤液中加入过量的AgNO3溶液,过滤、洗涤、干燥、称量,测量所得沉淀AgCl的质量为28.7g。
①HSO3Cl遇水发生反应的化学方程式为___。
②产品HSO3Cl的纯度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精。为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
①部分物质的沸点:
物质 | 水 | 乙醇 | 乳酸 | 苯 | 乳酸乙酯 |
沸点/℃ | 100 | 78.4 | 122 | 80.10 | 154 |
②乳酸乙酯易溶于苯、乙醇;水、乙醇、苯的混合物在64.85℃时,能按一定的比例以共沸物的形式一起蒸发。
该研究性学习小组同学拟采用如图所示(未画全)的主要装置制取乳酸乙酯,其主要实验步骤如下:
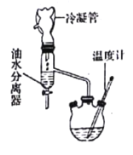
第一步:在反应容器中加入0.1 mol无水乳酸、45.0 mL(密度:0.789g/cm3)无水乙醇、一定量的苯和沸石……;装上油水分离器和冷凝管,缓慢加热回流2 h至反应完全。
第二步:将反应容器中液体倒入盛有适量5%Na2CO3溶液的烧杯中,搅拌并分出有机相后,再用水洗。
第三步:将无水CaCl2加入到水洗后的产品中充分静置,过滤、蒸馏,得产品7.08 g。
(1)第一步操作中,还缺少的试剂是______________________;加入苯的目的是_________________;实验过程中,若油水分离器中水层不再增厚,则表明___________________________________。
(2)第二步中证明“水洗”已经完成的实验方案是_______________________________ 。
(3)本实验制备乳酸乙酯的产率为_________________________。
Ⅱ.磷化铝、磷化锌、磷化钙与水反应产生高毒的PH3气体(熔点为-132℃,还原性强,易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量低于0.05m·kg-1时算合格。可用以下方法测定粮食中残留的磷化物含量:
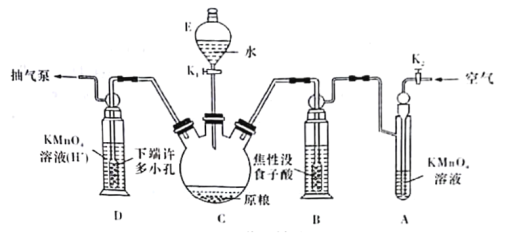
(操作流程)安装吸收装置![]() PH3的产生与吸收
PH3的产生与吸收![]() 转移KMnO4吸收溶液
转移KMnO4吸收溶液![]() 亚硫酸钠标准溶液滴定。
亚硫酸钠标准溶液滴定。
(实验装置)C中盛100 g原粮,D中盛有20.00mL 1.12×10-4 mol·L-1KMnO4溶液(H2SO4酸化)。请回答下列问题:
(4)仪器C的名称是______________;检查整套装置气密性的方法是___________________________________________________________________________。
(5)A中盛装KMnO4,溶液的作用是除去空气中的还原性气体;B中盛装焦性没食子酸的碱性溶液.其作用是______________________________。D中PH3被氧化成磷酸,所发生反应的离子方程式为____________________________________________。
(6)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-5 mol·L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗标准Na2SO3溶液11.00 mL,则该原粮中磷化物(以PH3计)的含量为_________________________mg·kg-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com