
【题目】一定温度和压强下,N2(g)和H2(g)反应生成2molNH3(g),放出92.4kJ热量。在同温同压下向密闭容器中通入lmolN2和3molH2,达平衡时放出热量为QlkJ;向另一体积相同的容器中通入0.5molN2和l.5molH2,相同温度下达到平衡时放出热量为Q2kJ。则下列叙述正确的是
A. 2Q2l<92.4kJ B. 2Q2=Q1=92.4kJ
C. 2Q2>Q1=92.4kJ D. 2Q2=Q1<92.4kJ
【答案】A
【解析】N2(g)和H2(g)反应生成2molNH3(g),放出92.4kJ热量,该反应的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4kJ/mol;由于N2(g)和H2(g)反应生成NH3(g)的反应为可逆反应,所以Q1
2NH3(g)ΔH=-92.4kJ/mol;由于N2(g)和H2(g)反应生成NH3(g)的反应为可逆反应,所以Q1![]() 92.4kJ,Q2
92.4kJ,Q2![]() 46.2kJ。向另一体积相同的容器中通入0.5molN2和l.5molH2,可设计成先向一个体积为原密闭容器体积1/2的容器中通入0.5molN2和l.5molH2,然后将体积变为与原密闭容器相同;在一个体积为原密闭容器体积1/2的容器中通入0.5molN2和l.5molH2,在相同条件下反应达到平衡时放出的热量为Q1/2kJ;再将体积变为与原密闭容器相同,即减小压强,平衡逆向移动,放出的热量减少,则Q2
46.2kJ。向另一体积相同的容器中通入0.5molN2和l.5molH2,可设计成先向一个体积为原密闭容器体积1/2的容器中通入0.5molN2和l.5molH2,然后将体积变为与原密闭容器相同;在一个体积为原密闭容器体积1/2的容器中通入0.5molN2和l.5molH2,在相同条件下反应达到平衡时放出的热量为Q1/2kJ;再将体积变为与原密闭容器相同,即减小压强,平衡逆向移动,放出的热量减少,则Q2![]() Q1/2;则2Q2<Ql<92.4kJ,答案选A。
Q1/2;则2Q2<Ql<92.4kJ,答案选A。


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】已知反应O2(g)+2Cl2(g) ![]() 2Cl2O(g) △H>0,在三个恒温、恒容的密闭容器中分别充人lmolO2与2molCl2,测得平衡时O2的转化率如下表.下列说法正确的是( )
2Cl2O(g) △H>0,在三个恒温、恒容的密闭容器中分别充人lmolO2与2molCl2,测得平衡时O2的转化率如下表.下列说法正确的是( )
容器编号 | 温度(℃) | 容器体积/L | 平衡时O2转化率 | 平衡时压强(Pa) |
① | 200 | V1 | 50% | P1 |
② | 200 | V2 | 70% | P2 |
③ | 350 | V3 | 50% | P3 |
A. 反应速率:③>①>②
B. 平衡时压强:P1>P2
C. 容器体积:V1<V3
D. 若实验②中O2和Cl2用量均加倍,则平衡时O2的转化率小于70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,对于反应N2(g)+3H2(g) ![]() 2NH3(g)△H=-92.4 kJ·mol-1。N2的平衡转化率(
2NH3(g)△H=-92.4 kJ·mol-1。N2的平衡转化率(![]() )与体系总压强(P)的关系如右图所示。下列说法正确的是( )
)与体系总压强(P)的关系如右图所示。下列说法正确的是( )
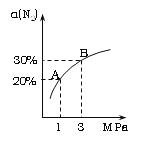
A. 将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ。
B. 平衡状态由A变到B时,平衡常数K(A) < K(B)
C. 上述反应在达到平衡后,增大压强,H2的转化率提高
D. 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是 ( )
A. 范德华力、范德华力、范德华力
B. 范德华力、范德华力、共价键
C. 范德华力、共价键、共价键
D. 共价键、共价键、共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D 4种短周期元素,它们的元素原子序数依次增大,由B、C、D形成的离子具有相同的电子层结构.B原子的最外层电子数是次外层的三倍,C、D单质都能跟水剧烈反应,1mol D单质跟水反应产生11.2L(标准状况)A气体,此时D转化为具有氖原子核外电子层结构的离子.试填写:
(1)用电子式表示A和C形成化合物的过程 .
(2)C原子的结构示意图 , 写出A、B两元素按1:1原子个数比形成化合物的电子式 .
(3)这4种元素的原子半径由大到小的顺序为 . (用元素符号表示)
(4)写出C单质与水反应的化学反应方程式;.
(5)写出D单质与水反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《茶疏》中对泡茶过程有如下记载:“治壶、投茶、出浴、淋壶、烫杯、酾茶、品茶…… ”文中未涉及下列操作原理的是
A. 溶解 B. 萃取 C. 蒸馏 D. 过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法不正确的是
A. 1L1mol·L-1的NaHS溶液中含有HS-的数目小于NA
B. 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA
C. 1mo1C2H4和C3H6的混合气体中含有的碳原子数为2NA
D. 10gH218O含有的中子数为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O, 则下列说法正确的是( )
2PbSO4+2H2O, 则下列说法正确的是( )
A. 放电时:当外电路通过1mol的电子时,理论上负极板的质量增加了151.5g
B. 充电时:阳极反应是PbSO4-2e-+2H2O = PbO2+SO42-+4H+
C. 放电时:正极反应是Pb-2e-+SO42-= PbSO4
D. 充电时:铅蓄电池的阴极应与电源的正极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com