
【题目】设NA为阿伏加德罗常数的值。下列说法不正确的是
A. 1L1mol·L-1的NaHS溶液中含有HS-的数目小于NA
B. 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA
C. 1mo1C2H4和C3H6的混合气体中含有的碳原子数为2NA
D. 10gH218O含有的中子数为5NA
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】在无色透明强酸性溶液中,能大量共存的离子组是 ( )
A. K+、MnO4-、SO42- B. Na+、Cl-、CO32-
C. Zn2+、Al3+、Cl- D. Na+、Fe2+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种新型高温可充电电池(电池活性物质为Na和S),则下列说法中正确的是
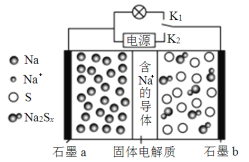
A.放电时,Na+由石墨b向石墨a迁移
B.充电时石墨b与外接电源负极相连
C.可将装置中的固体电解质改成NaCl溶液
D.放电时石墨b上发生的反应为:2Na++xS+2e![]() Na2Sx
Na2Sx
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.10mol/L的盐酸分别滴定20.00mL浓度均为0.10mol/L氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积的变化关系如图所示。下列说法不正确的是

A. 当滴定氨水消耗V(HCl)=10 mL时,有:2[c(OH-)-c(H+)]=c(NH4+)-c(NH3·H2O)
B. 当pH=7时,滴定氨水消耗的V(HCl)<20 mL,且溶液中c(NH4+)=c(Cl-)
C. 当滴定氨水消耗V(HCl)=20 mL时,有:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D. 滴定氢氧化钠溶液,V(HCl)>20 mL时一定有:c(Cl-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为______mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是______;
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为 0.400mol·L-1的稀盐酸。
①容量瓶上需标有以下五项中的________。
A.温度 B.浓度 C.容量 D.压强 E.刻度线
②将下列操作填写完整,并排列其正确的操作顺序________(用字母表示,每个字母只能用一次);
A.用少量蒸馏水洗涤________2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。
B.用量筒准确量取浓盐酸 ________mL,注入烧杯中,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其混合均匀。
C.将已冷却的盐酸沿玻璃杯注入________中。
D.盖好瓶塞,颠倒摇匀,装瓶,贴签。
E.改用__________加水,至_____________________________。
F.继续往容量瓶内小心加水,直到液面接近刻度________处。
③在配制过程中,下列实验操作对所配制的稀盐酸物质的量浓度有何影响? (在横线上天“偏大”、“偏小”、“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面__________;
b.洗涤量取浓盐酸后的量筒,并将洗涤液转移到容量瓶中__________;
c.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水___________;
d.定容时仰视刻度线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO 等。现以硫酸渣制备铁红(Fe2O3),过程如下:

(1) 酸溶过程中Fe2O3与稀硫酸反应的离子方程式是_________________________。
(2) 还原过程中加入FeS2是将溶液中的Fe3+ 还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:__________________________________________。检验Fe3+被完全还原的实验操作和现象是:________________________________________________。
(3) 氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式:_____________________________________________。
(4) 生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是_____。
(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(5) 滤液B可以回收的物质有____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常以铝土矿(主要成分为Al2O3,含有少量Fe2O3、SiO2等杂质)为原料制备无水氯化铝:2Al2O3+6Cl2===4AlCl3+3O2。
回答以下问题:
(1)为促进反应的进行,实际生产中需加入焦炭,其原因是____________________。
(2)加入焦炭后的化学反应可表示为Al2O3+C+Cl2△,AlCl3+X↑,则气体X可能是
___________________________________________________________。
(3)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2,从而避免在AlCl3中混入铁的氯化物。该反应的化学方程式为________________。
(4)以铝土矿为原料可以通过以下途径提纯氧化铝:

①写出滤液甲中溶质的化学式:______________________________。
②写出滤液乙中加入过量氨水得到Al(OH)3的离子方程式:_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com