
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO 等。现以硫酸渣制备铁红(Fe2O3),过程如下:

(1) 酸溶过程中Fe2O3与稀硫酸反应的离子方程式是_________________________。
(2) 还原过程中加入FeS2是将溶液中的Fe3+ 还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:__________________________________________。检验Fe3+被完全还原的实验操作和现象是:________________________________________________。
(3) 氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式:_____________________________________________。
(4) 生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是_____。
(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(5) 滤液B可以回收的物质有____________________________________________。
【答案】 Fe2O3 + 6H+ = 2Fe3+ + 3H2O FeS2 + 14Fe3 + + 8H2O = 15Fe2 + + 2SO42- + 16H+ 取少量试液于试管中,滴入几滴KSCN溶液,若不显红色,则说明Fe3 +已被完全还原 4Fe2 + + O2 + 2H2O + 8OH-= 4Fe(OH)3↓或Fe2++2OH-=Fe(OH)2↓, 4Fe(OH)2+O2+2H2O=4Fe(OH)3 3.2~3.8 Al2(SO4)3、MgSO4、Na2SO4
【解析】硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,稀硫酸溶解主要除去不与酸反应的SiO2,加入FeS2将溶液中的Fe3+还原为Fe2+,再加氢氧化钠和空气,调节溶液的pH的范围是3.2~3.8主要是使三价铁沉淀,而二价镁,三价铝都不沉淀,最后洗涤、烘干、研磨使氢氧化铁分解生成氧化铁,从而得到铁红。
(1)氧化铁与硫酸反应生成硫酸铁和水,方程式为:Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;离子方程式为Fe2O3 + 6H+ = 2Fe3+ + 3H2O,故答案为:Fe2O3 + 6H+ = 2Fe3+ + 3H2O;
(2)FeS2中S元素的化合价从-1价升高到+6价,2个S原子转移14个电子,Fe3+转移1个电子,则二者的计量数之比为1:14,根据S守恒可知SO42-前面的化学计量数为2,根据氧守恒可知H20前面化学计量数为8,根据H守恒可知H+前化学计量数为16,则反应的离子方程式为:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+,检验Fe3+被完全还原的实验操作和现象为取少量试液于试管中,滴入几滴KSCN溶液,若不显红色,则说明Fe3 +已被完全还原,故答案为:FeS2 + 14Fe3 + + 8H2O = 15Fe2 + + 2SO42- + 16H+;取少量试液于试管中,滴入几滴KSCN溶液,若不显红色,则说明Fe3 +已被完全还原;
(3)Fe2+与OH-反应生成4Fe(OH)2,Fe(OH)2不稳定易被氧气氧化为Fe(OH)3,用化合价升价法配平方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓,故答案为:4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓;
(4)溶液pH>3.2时Fe3+沉淀完全,溶液pH=3.8时Al3+开始沉淀,故溶液的pH的范围是3.2~3.8,根据几种离子沉淀的pH,如果pH过大,Al3+、Mg2+形成沉淀,使制得的铁红不纯;故答案为:3.2~3.8;
(5)未沉淀的离子为Na+、Mg2+、Al3+,故滤液B可以回收的物质有:Na2SO4、Al2(SO4)3、MgSO4,故答案为:Na2SO4、Al2(SO4)3、MgSO4。


科目:高中化学 来源: 题型:
【题目】如图在盛有溴水的三支试管中分别加入酒精、四氯化碳和苯,振荡后静置,出现下列现象,正确的结论是( )

A. ①加了CCl4 ②加了苯 ③加了酒精
B. ①加了苯 ②加了CCl4 ③加了酒精
C. ①加了酒精 ②加了CCl4 ③加了苯
D. ①加了苯 ②加了酒精 ③加了CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法不正确的是
A. 1L1mol·L-1的NaHS溶液中含有HS-的数目小于NA
B. 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA
C. 1mo1C2H4和C3H6的混合气体中含有的碳原子数为2NA
D. 10gH218O含有的中子数为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入NH30.4mol,甲室中充入HCl、N2的混合气体,静止时隔板位置如图所示。已知甲、乙两室中气体的质量之差为17.3g。
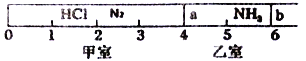
(1)甲室中HCl、N2的质量之比为__________________。
(2)将隔板a去掉,一段时间后,隔板b将稳定位于刻度“________’’处(填数字,不考虑固体物质产生的压强),此时体系的平均相对分子质量为________。
Ⅱ.已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶质的物质的量浓度/molL-1 | 溶液的密度/gcm-3 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为________(不写单位,用含c1、ρ1,的代数式表示)。
(2)物质的量浓度为c1molL-1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为________molL-1。
(3)将物质的量浓度分别为c2molL-1和0.2c2molL-1的氨水等质量混合,所得溶液的物质的量浓度__________0.6c2molL-1(填“大于”、“小于”或“等于”)(设混合后溶液的体积变化忽略不计)
Ⅲ.电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极)。

若用NO2气体进行模拟电解法吸收实验。
①写出电解时NO2发生反应的电极反应式:_________________________________。
②若有标准状况下2.24LNO2被吸收,通过阳离子交换膜的H+为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯原子的质量是a g,12C原子的质量是b g,若NA只表示阿伏加德罗常数的数值,则下列说法中正确的是( )
(1)该氯原子的相对原子质量为![]() (2)m g该氯原子的物质的量为
(2)m g该氯原子的物质的量为![]() mol
mol
(3)该氯原子的摩尔质量是aNA g (4)a g该氯原子所含的电子数为17NA
A. (1)(3) B. (1)(2) C. (2)(4) D. (2)(3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清华大学王晓琳教授首创三室电解法制备LiOH,其工作原理如图所示,下列说法正确的是

A.X电极连接电源负极
B.Y电极反应式为O2+2H2O+4e![]() 4OH
4OH
C.N为阳离子交换膜
D.制备2.4 g LiOH产生的H2在标准状况下为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)19g 某二价金属的氯化物ACl2中含有0.4mol Cl-离子,ACl2的摩尔质量是___________,该物质的化学式是_____________。
(2)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入b g A气体,Y中充入b g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为________。
(3)同温同压下,SO3与SO2的密度之比为________;若体积相同时,两种气体的氧元素质量之比为________。
(4)4.2 g N2与4.8 g某单质Rx,所含的原子个数相同,且分子数之比为3:2,则R的相对原子质量是________,x值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】框图中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。

请问答下列问题:
(1)反应①-⑤中,既属于氧化还原反应又属于化合反应的是______________(填序号)。
(2)反应⑤的化学方程式为__________________________________________________。
(3)甲与B反应的离子方程式 ________________________________________________。
(4)在实验室将C溶液滴入F溶液中,观察到的现象是_____________________________。
(5)在F溶液中加入等物质的量的A,发生反应的总的离子方程式为:_________________。
(6)已知:酚酞在c(OH-) 为1.0×10-4mol/L~2.5mol/L时呈红色,且半分钟内不褪色。向3.9g A和50g B混合后的溶液中滴入2滴酚酞试液,溶液变红色,片刻红色褪去(假设过程中液体体积不变)。
①甲同学认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的,上述观点是否正确_______。
②你认为“红色迅速褪去”是由于____________________________________________导致的(用化学方程式和必要的文字说明)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com