
【题目】如图在盛有溴水的三支试管中分别加入酒精、四氯化碳和苯,振荡后静置,出现下列现象,正确的结论是( )

A. ①加了CCl4 ②加了苯 ③加了酒精
B. ①加了苯 ②加了CCl4 ③加了酒精
C. ①加了酒精 ②加了CCl4 ③加了苯
D. ①加了苯 ②加了酒精 ③加了CCl4
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是 ( )
A. 加热 B. 将稀硫酸改为98%的浓硫酸
C. 滴加少量CuSO4溶液 D. 铁片改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列叙述中正确的是
A.一定量的铜与足量的浓硝酸反应收集到的气体体积为4.48 L(标准状况)时生成的Cu2+数为0.1NA
B.1.2 g熔融的NaHSO4中含有0.02NA个阳离子
C.电解精炼铜时,若阴极质量增加6.4 g,则电路中转移的电子数为0.2NA
D.在含![]() 总数为NA的NH4Cl溶液中,Cl总数为NA
总数为NA的NH4Cl溶液中,Cl总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3混合物中加入100 mL 1 mol/L盐酸,恰好使混合物完全溶解,放出224 mL(标准状况下)的气体,在所得溶液中加入KSCN溶液,无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,可得到铁的质量是( )
A. 11.2g B. 5.6g C. 2.8g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸微溶于水,熔点122.4℃、沸点248℃。实验室用甲苯和高锰酸钾溶液反应,方程式为C6H5—CH3+KMnO4![]() C6H5—COOK,制得苯甲酸钾,然后再酸化,制得苯甲酸。装置如图所示(部分夹持装置已略去):
C6H5—COOK,制得苯甲酸钾,然后再酸化,制得苯甲酸。装置如图所示(部分夹持装置已略去):

(1)实验时,把1.84 g C6H5—CH3和4.5 g KMnO4、适量蒸馏水加入三颈瓶,用搅拌器搅拌的目的是________________________。加热至沸腾,冷凝管中的水应从_____口进(填“a”或“b”)。
(2)加热一段时间后,直到甲苯层几乎近于消失,回流液不再出现油珠,此时反应混合液仍为紫色,停止加热,从分液漏斗慢慢加入适量饱和亚硫酸钠溶液,实验现象为________________________,该反应有一种碱、一种盐和二氧化锰生成,化学方程式为________________________,该反应中氧化产物为__________(填化学式),若有1 mol二氧化锰生成,转移_____mol电子。
(3)将反应混合物趁热过滤,把滤液和洗涤液混合,冷却,用浓盐酸酸化,发生反应的化学方程式为:_____________________________。
(4)将苯甲酸洗涤、干燥、称重,得1.71 g苯甲酸,本实验中苯甲酸的产率为_____%(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明强酸性溶液中,能大量共存的离子组是 ( )
A. K+、MnO4-、SO42- B. Na+、Cl-、CO32-
C. Zn2+、Al3+、Cl- D. Na+、Fe2+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种新型高温可充电电池(电池活性物质为Na和S),则下列说法中正确的是
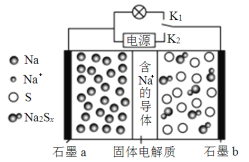
A.放电时,Na+由石墨b向石墨a迁移
B.充电时石墨b与外接电源负极相连
C.可将装置中的固体电解质改成NaCl溶液
D.放电时石墨b上发生的反应为:2Na++xS+2e![]() Na2Sx
Na2Sx
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO 等。现以硫酸渣制备铁红(Fe2O3),过程如下:

(1) 酸溶过程中Fe2O3与稀硫酸反应的离子方程式是_________________________。
(2) 还原过程中加入FeS2是将溶液中的Fe3+ 还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:__________________________________________。检验Fe3+被完全还原的实验操作和现象是:________________________________________________。
(3) 氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式:_____________________________________________。
(4) 生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是_____。
(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(5) 滤液B可以回收的物质有____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com