
【题目】将a mol钠和a mol铝一同投入m g足量水中,所得溶液密度为d g·mL-1,该溶液中溶质质量分数为( )
A. ![]() % B.
% B. 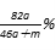 C.
C. ![]() % D.
% D. ![]() %
%
【答案】A
【解析】由2Na+2H2O═2NaOH+H2↑和2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,将a mol钠和a mol铝一同投入m g足量水中,共得到氢气的物质的量为2a mol,生成偏铝酸钠的物质的量为a mol.所以,所得溶质的质量为82ag,所得溶液的质量为:23ag+27ag+mg-4ag=(46a+m)g。所得溶液的溶质质量分数为: ![]() ×100%=
×100%=![]() %。由以上计算可知:A、溶液的溶质质量分数不是
%。由以上计算可知:A、溶液的溶质质量分数不是![]() %,选项A错误;B、溶液的溶质质量分数不是
%,选项A错误;B、溶液的溶质质量分数不是![]() %,选项B错误;C、溶液的溶质质量分数是
%,选项B错误;C、溶液的溶质质量分数是![]() %,选项C正确;D、溶液的溶质质量分数不是
%,选项C正确;D、溶液的溶质质量分数不是![]() %,选项D错误。答案选C。
%,选项D错误。答案选C。


科目:高中化学 来源: 题型:
【题目】在共价化合物中,元素化合价有正负的主要原因是 ( )
A. 电子有得失 B. 电子既有得失又有电子对偏移
C. 共用电子对有偏移 D. 有金属元素的存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,写出与盐酸反应最慢的金属发生反应的离子方程式__________。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理___________?并说明理由:________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。

(3)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置B中所装药品为_____________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_________________________。
(4)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加Na2SiO3,观察到C中的实验现象为有白色沉淀物生成。离子方程式为____________________(假设所通气体是过量的)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用王水(浓硝酸和浓盐酸按体积比1:3的混合物)来溶解白金等贵金属进行科学实验。王教授用质量分数为63%的浓硝酸(密度1.40g/ ![]() )和质量分数为36.5%的浓盐酸(密度1.19g/
)和质量分数为36.5%的浓盐酸(密度1.19g/ ![]() )来配制王水600毫升,假设忽略两种酸混合时的体积变化也不考虑混合后的化学变化,下列说法错误的是
)来配制王水600毫升,假设忽略两种酸混合时的体积变化也不考虑混合后的化学变化,下列说法错误的是
A. 该王水中硝酸的物质的量浓度是3.5mol/L
B. 该王水中氧元素的质量是100.8g
C. 该王水的密度约为1.24g/ ![]()
D. 该王水中HCl的质量分数约为26.2%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱金属在电池、催化剂等领域有着广泛的用途,关于碱金属单质的性质叙述错误的是( )
A. 都是电和热的良导体 B. 从 Li 至 Cs,熔点逐渐降低
C. 都是柔软的银白色金属(铯略带金色) D. 都可以保存在煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
A. 直线形;三角锥形
B. V形;三角锥形
C. 直线形;平面三角形
D. V形;平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁和铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如右图所示。则下列说法不正确的是

A.镁和铝的总质量为9 g
B.最初20 mLNaOH溶液用于中和过量的硫酸
C.硫酸的物质的量浓度为2.5 mol·L-1
D.生成的氢气在标准状况下的体积为11.2 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com