
100 mL 6 mol·L-1的H2SO4溶液跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成 氢气的总
氢气的总 量,可向反应物中加入适量的( )
量,可向反应物中加入适量的( )
①Na2CO3溶液 ②水 ③K2SO4溶液 ④KNO3溶液
A.①③ B.②③ C.①④ D.②④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
短周期元素Q、R、T、W在元素周期表中的位置如图K154所示,其中T所处的周期序数与主族序数相等。

图K154
(1)T的原子结构示意图是________。用化学方程式表示工业上常用于冶炼T单质的原理:________________________。
(2)与W同主族的某元素,其氢化物分子中含有18个电子,该分子中的共价键类型是__________________。
(3)元素的非金属性:Q________W(填“强于”或“弱于”)。结合方程式阐述其原因:________________________________________________________________________
________________________________________________________________________。
(4)甲是R的氧化物,通常状况下呈红棕色。现有一试管甲,欲使元素R全部转化为其最高价氧化物对应的水化物。实验步骤:将盛有甲的试管倒扣在水槽中,________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知酸性: 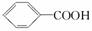 >H2CO3>
>H2CO3> 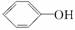 ,综合考虑反应物的转化率、原料成本、操作是否简便等因素,将
,综合考虑反应物的转化率、原料成本、操作是否简便等因素,将 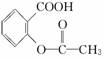 转变为
转变为 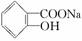 的最佳方法是( )
的最佳方法是( )
A.与稀H2SO4共热后,加入足量的NaOH溶液
B.与稀H2SO4共热后,加入足量的Na2CO3溶液
C.与足量的NaOH溶液共热后,再通入足量CO2
D.与足量的NaOH溶液共热后,再加入适量H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学课外活动小组的同学利用原电池原理探究一定温度下(实验时实际的环境温度)使铁钝化的硝酸的最低浓度。 实验步骤如下:
①向两支具支试管中分别加入浓硝酸5.0mL(质量分数为65%,密度为1.4g/mL)。按图组装好实验装置。
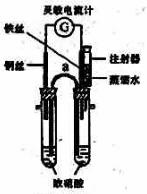 ②将铜丝和铁丝同时插入浓硝酸中,观察到灵敏电流计指针先指向铜丝,但又迅速反转(只需1—2s)指向铁丝一端。
②将铜丝和铁丝同时插入浓硝酸中,观察到灵敏电流计指针先指向铜丝,但又迅速反转(只需1—2s)指向铁丝一端。
③用盛有5.0mL蒸馏水的注射器向具支试管内加水,并注视电流计的指针偏转方向。在指针恰好发生反转又指向铜丝时停止实验,记录此时已注入的水的体积。
重复三次实验获得的数据如下:
| 实验次数 | 实验温度(℃) | 注入水的体积(mL) |
| 1 | 17.2 | 2.4 |
| 2 | T1 | 2.5 |
| 3 | T2 | 2.3 |
请回答下列问题:
(1)在该装置中仪器a因其作用而称为 ;指针指向铁丝时,铁丝为 极(填“正”或“负”)
(2)65%的硝酸的物质的量浓度是 ;在未注水前正极的电极反应式为 。
(3)T1 T2(填“>”、“<”或“=”)
(4)在本实验温度下,使铁钝化的硝酸最低浓度为 %;利用本实验数据判断,若以45%的硝酸进行实验(不再注水),则电流表的指针应指向 电极(填“铁”或“铜”)
(5)该实验装置上的不足是 ,改进方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述是某同学做完铜锌原电池实 验后得出的结论和认识,正确的是( )
验后得出的结论和认识,正确的是( )
A.构成原电池正极和负极的材料 必须是两种金属
必须是两种金属
B.由铜锌作 为电极与硫酸铜溶液组成的原电池中,铜是负极
为电极与硫酸铜溶液组成的原电池中,铜是负极
C.电流通过硫酸溶液,SO42- 向正极移动
D.铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol 电子通过
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质的比较正确的是
①同主族元素的单质从上到下,非金属性减弱,熔点增高
②元素的最高正化合价在数值上等于它所在的族序数
③同周期主族元素的原子半径越小,越难失去电子
④元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑤还原性:S2->Se2->Br->Cl-
⑥酸性:HClO4>H2SO4>H3PO4>H2SiO3
A.①③ B.②④ C.③⑥ D.⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
环丙烷可作为全身麻醉剂,环己烷是重要的有机溶剂。下面是部分环烷烃及烷烃衍生物的结构简式、键线式和某些有机化合物的反应式(其中Pt、Ni是催化剂)。

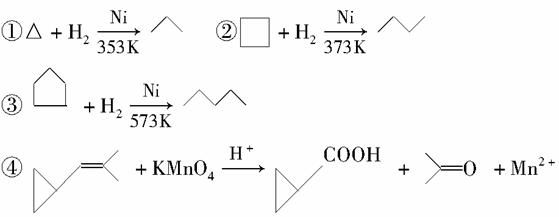
回答下列问题:
(1)环烷烃与____________是同分异构体。
(2)从反应①~③可以看出,最容易发生开环加成反应的环烷烃是__________(填名称)。判断依据为_____________________。
(3)环烷烃还可以与卤素单质,卤化氢发生类似的开环加成反应,如环丁烷与HBr在一定条件下反应,其化学方程式为_________(不需注明反应条件)。
(4)写出鉴别环丙烷和丙烯的一种方法。试剂__________;现象与结论______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断不正确的是
A.与NaOH反应的氯气一定为0.15 mol
B.n(Na+)∶n(Cl-) 可能为7∶3
C.若反应中转移的电子为n mol,则n一定大于0.15 mol
D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为7∶2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com