
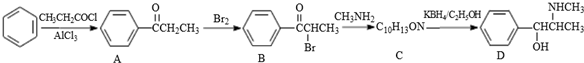
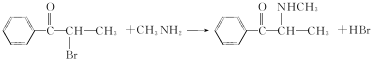 .C-D的反应类型为还原反应.
.C-D的反应类型为还原反应.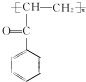 .
.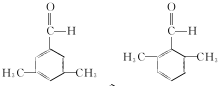 (写结构简式).
(写结构简式).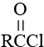 .参照上述合成路线,设计一条由苯和乙酸为起始原料制备
.参照上述合成路线,设计一条由苯和乙酸为起始原料制备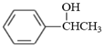 的合成路线:
的合成路线: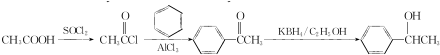 .
. 分析 (1)根据D的结构简式可知其分子式,根据B的结构简式可知其所含的官能团;
(2)比较B的结构简式与C的分子式可知,B与CH3NH2发生取代反应生成C,比较C的分子式与D的结构简式可知,C发生还原反应生成D,据此答题;
(3)B中溴原子与邻位碳上的氢原子发生消去反应生成碳碳双键,碳碳双键可以发生加聚反应,据此确定E的结构;
(4)根据条件①能发生银镜反应,说明有醛基,②苯环上的一氯代物有两种结构,其中核磁共振氢谱为4组峰,即苯环上有两种位置的氢原子,分子中有四种位置的氢原子,且峰面积之比为6:2:1:1,即个数比为6:2:1:1,据此可写出A的同分异构体;
(5)由苯和乙酸为起始原料制备 ,可以将CH3COOH与氯气发生信息中的取代反应生成CH3COCl,与苯在氯化铝作催化剂的条件下发生取代反应生成甲苯酮,甲苯酮发生还原反应即可得产品.
,可以将CH3COOH与氯气发生信息中的取代反应生成CH3COCl,与苯在氯化铝作催化剂的条件下发生取代反应生成甲苯酮,甲苯酮发生还原反应即可得产品.
解答 解:(1)根据D的结构简式可知其分子式为C10H15NO,根据B的结构简式可知其所含的官能团为羰基和溴原子,
故答案为:C10H15NO;羰基和溴原子;
(2)比较B的结构简式与C的分子式可知,B与CH3NH2发生取代反应生成C,反应方程式为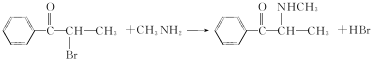 ,比较C的分子式与D的结构简式可知,C发生还原反应生成D,
,比较C的分子式与D的结构简式可知,C发生还原反应生成D,
故答案为: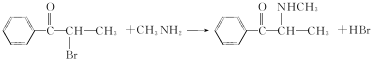 ;还原反应;
;还原反应;
(3)B中溴原子与邻位碳上的氢原子发生消去反应生成碳碳双键,碳碳双键可以发生加聚反应得到E为 ,
,
故答案为: ;
;
(4)根据条件①能发生银镜反应,说明有醛基,②苯环上的一氯代物有两种结构,即苯环上有两种位置的氢原子,则符合条件的A的同分异构体为苯环的对位上连有两个基团:-CH2CH3、-CHO或:-CH2CHO、-CH3,也可以是连有三个基团结构为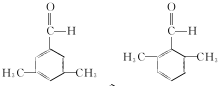 ,所以共有4种,其中核磁共振氢谱为4组峰,分子中有四种位置的氢原子,且峰面积之比为6:2:1:1,即个数比为6:2:1:1的A的同分异构体为
,所以共有4种,其中核磁共振氢谱为4组峰,分子中有四种位置的氢原子,且峰面积之比为6:2:1:1,即个数比为6:2:1:1的A的同分异构体为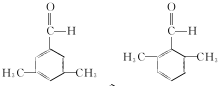 ,
,
故答案为:4;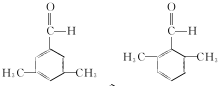 ;
;
(5)由苯和乙酸为起始原料制备 ,可以将CH3COOH与氯气发生信息中的取代反应生成CH3COCl,与苯在氯化铝作催化剂的条件下发生取代反应生成甲苯酮,甲苯酮发生还原反应即可得产品,其合成路线为
,可以将CH3COOH与氯气发生信息中的取代反应生成CH3COCl,与苯在氯化铝作催化剂的条件下发生取代反应生成甲苯酮,甲苯酮发生还原反应即可得产品,其合成路线为 ,
,
故答案为: .
.
点评 本题涉及有机化合物之间的转化关系、官能团及性质、有机反应类型、有条件的同分异构体的书写、有机合成等相关知识,明确有机物的官能团及其性质是解本题关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Al2O3 | B. | SiO2 | C. | Fe2O3 | D. | MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
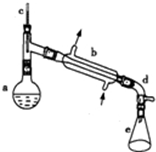 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
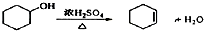 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH3在该反应中作还原剂,被氧化 | |
| B. | Si3N4具有硬度大、熔点高,说明Si3N4可用作耐高温材料 | |
| C. | 标准状况下,22.4LNH3所含原子总数目为4×6.02×1023 | |
| D. | 该反应每生成1mol Si3N4转移电子总数目为12×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
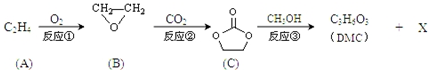
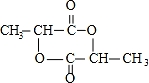 ;
;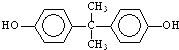 )在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n
)在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n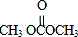 +n
+n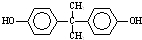 →
→ +4nCH3OH.
+4nCH3OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物.请回答下列问题:
过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L 甲醇完全燃烧后生成的 CO2 分子个数约为$\frac{1}{2.42}$N A | |
| B. | N A个H2分子的质量约为2g,它所占的体积约为 22.4L | |
| C. | 标准状况下,22.4L CO2与CO的混合气体中含有的碳原子数为N A | |
| D. | 500mL 0.5mol/L 的Ca(ClO)2溶液中,含有ClO-的数目为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com