
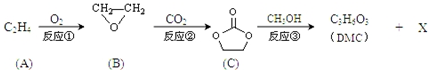
 ;
;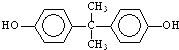 )在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n
)在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n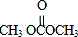 +n
+n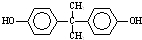 →
→ +4nCH3OH.
+4nCH3OH. 分析 由合成流程可知,反应①为加成反应生成环氧乙烷,反应②为C=O键的加成反应,反应③为C与甲醇的取代反应生成DMC(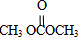 )和X(HOCH2CH2OH),然后结合有机物的结构与性质来解答.
)和X(HOCH2CH2OH),然后结合有机物的结构与性质来解答.
解答 解:由合成流程可知,反应①为加成反应生成环氧乙烷,反应②为C=O键的加成反应,反应③为C与甲醇的取代反应生成DMC(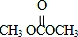 )和X(OHCH2CH2OH),
)和X(OHCH2CH2OH),
(1)由上述分析可知,①为加成反应,
故答案为:加成反应;
(2)由上述分析可知,X为HOCH2CH2OH,
故答案为:HOCH2CH2OH;
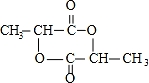
(3)Y与DMC互为同分异构体,Y的水溶液呈酸性,在一定条件下2mol Y能生成1mol分子中含六元环结构的有机物Z,Y中含1个-COOH,则Y的结构简式为CH3CH(OH)COOH,Z为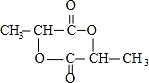 ,
,
故答案为: ;
;
(4)DMC与双酚(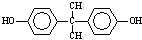 )在一定条件下可生成芳香族聚碳酸酯,反应的化学方程式为:2n
)在一定条件下可生成芳香族聚碳酸酯,反应的化学方程式为:2n +n
+n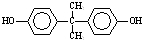 →
→ +4nCH3OH,
+4nCH3OH,
故答案为:2n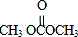 +n
+n →
→ +4nCH3OH.
+4nCH3OH.
点评 本题考查有机物推断与合成、有机反应类型、同分异构体书写等,侧重于学生的分析能力的考查,注意把握有机物的结构和官能团的性质,易错点为(4),注意理解给予信息.


科目:高中化学 来源: 题型:解答题
 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.
2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
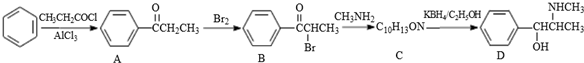
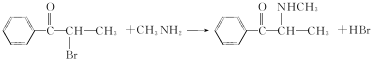 .C-D的反应类型为还原反应.
.C-D的反应类型为还原反应.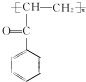 .
.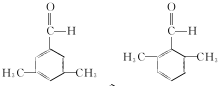 (写结构简式).
(写结构简式).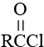 .参照上述合成路线,设计一条由苯和乙酸为起始原料制备
.参照上述合成路线,设计一条由苯和乙酸为起始原料制备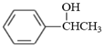 的合成路线:
的合成路线: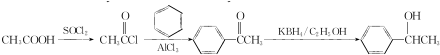 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
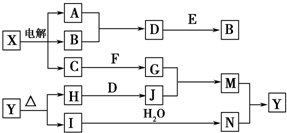 框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去).已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀.
框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去).已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 | |
| B. | 乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键 | |
| C. | 丙中含有第2周期ⅣA 族的元素,则丙可能是甲烷的卤代物 | |
| D. | 丁和甲中各元素质量比相同,则丁可能是C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 金属铝溶于氢氧化钠溶液中:Al+2OH-═Al${O}_{2}^{-}$+H2↑ | |
| C. | 金属铝溶于盐酸中:2Al+6H+═2Al3++3H2↑ | |
| D. | Fe(OH)3跟盐酸反应:OH-+H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的摩尔质量为44g | |
| B. | 1 mol N2的质量是14g | |
| C. | 标准状况下,1 mol CO2所占的体积约是22.4L | |
| D. | 将40 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com