
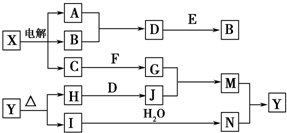
 框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去).已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀.
框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去).已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀.分析 已知A、B为气态单质,F是地壳中含量最多的金属元素的单质判断为Al;E、H、I为氧化物,M为红褐色沉淀为Fe(OH)3,转化关系中X电解得到AB为气体,二者反应生成D,E为黑色固体,和D反应又生成B气体,推断电解的是氯化钠溶液生成的气体A为H2,B为Cl2,C为NaOH,D为HCl,E为MnO2,G为NaAlO2,根据生成氢氧化铁沉淀为M,所以J是含三价铁离子的物质,是H和D反应生成,证明J为FeCl3,E、H、I为氧化物判断H为Fe2O3;I为红棕色气体为NO2;N为HNO3,Y为Fe(NO3)3,结合物质的性质来解答.
解答 解:已知A、B为气态单质,F是地壳中含量最多的金属元素的单质判断为Al;E、H、I为氧化物,M为红褐色沉淀为Fe(OH)3,转化关系中X电解得到AB为气体,二者反应生成D,E为黑色固体,和D反应又生成B气体,推断电解的是氯化钠溶液生成的气体A为H2,B为Cl2,C为NaOH,D为HCl,E为MnO2,G为NaAlO2,根据生成氢氧化铁沉淀为M,所以J是含三价铁离子的物质,是H和D反应生成,证明J为FeCl3,E、H、I为氧化物判断H为Fe2O3;I为红棕色气体为NO2;N为HNO3,Y为Fe(NO3)3,
(1)B为Cl2中所含元素位于周期表第三周期,ⅤⅡA族,
故答案为:三;ⅤⅡA;
(2)A为H2在B为Cl2中燃烧的现象是:气体安静燃烧,火焰呈苍白色,并有白雾产生,故答案为:气体安静燃烧,火焰呈苍白色,并有白雾产生;
(3)D+E→B的反应为MnO2+4HCl=MnCl2+Cl2↑+2H2O,n(被氧化的物质HCl):n(被还原的物质MnO2)=2:1,故答案为:2:1;
(4)G(NaAlO2)+J(FeCl3)→M(Fe(OH)3)的反应是在水溶液中发生的双水解反应,反应离子方程式是:3AlO2-+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓,
故答案为:3AlO2-+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓;
(5)依据分析推断可知Y为Fe(NO3)3,受热分解生成二氧化氮和氧化铁,依据原子守恒配平书写的化学方程式是:4Fe(NO3)3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+12NO2↑+3O2↑,
故答案为:4Fe(NO3)3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+12NO2↑+3O2↑.
点评 本题考查了物质转化关系和物质性质的应用,主要考查电子式书写,离子方程式的书写,盐类水解的应用,特征反应是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲苯的结构式:C7H8 | B. | 乙烷的结构简式:CH3CH3 | ||
| C. | 甲醇的电子式:CH3OH | D. | 乙醇的分子式:CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH3在该反应中作还原剂,被氧化 | |
| B. | Si3N4具有硬度大、熔点高,说明Si3N4可用作耐高温材料 | |
| C. | 标准状况下,22.4LNH3所含原子总数目为4×6.02×1023 | |
| D. | 该反应每生成1mol Si3N4转移电子总数目为12×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
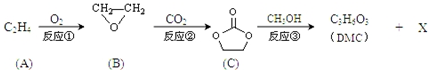
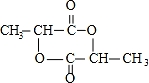 ;
;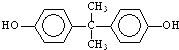 )在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n
)在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n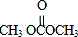 +n
+n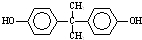 →
→ +4nCH3OH.
+4nCH3OH.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
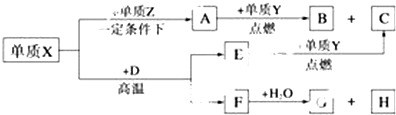
 ,A的电子式
,A的电子式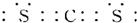 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2ml0.3mol/L的硅酸钠溶液中滴入稀盐酸所制得的硅酸胶体中胶粒的数目为0.0006NA | |
| B. | 常温下,1LpH=2的H2S溶液中H+的数目为0.01NA | |
| C. | 1mol铁粉与22.4L(标准状况)氯气充分反应,转移的电子数是3NA | |
| D. | 常温常压下,2.8gC4H8中有1.2NA的共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
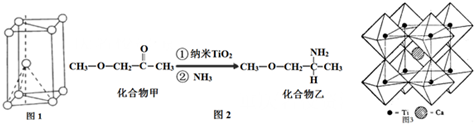
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com