
将CO2持续通入下列八种饱和溶液:①Na2CO3 ②K2SiO3 ③Na[Al(OH)4] ④K2SO3
⑤Ca(ClO)2 ⑥BaCl2和NH3 ⑦NH3和NaCl ⑧Ca(OH)2,最终能够得到沉淀或析出晶体的是
A.②⑤⑥⑧ B.③④⑤⑧ C.①④⑥⑦ D.①②③⑦
科目:高中化学 来源:2014-2015学年江苏省镇江市高三第一学期期末调研测试化学试卷(解析版) 题型:实验题
(16分)绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
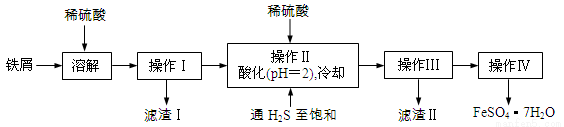
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)通入硫化氢的作用是:
①除去溶液中的Sn2+离子
②除去溶液中的Fe3+,其反应的离子方程式为 ;操作II,在溶液中用硫酸酸化至pH=2的目的是 。
(2)操作IV的顺序依次为: 、 、过滤、洗涤、干燥。
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
② 。
(4)测定绿矾产品中Fe2+含量的方法是:
a.称取一定质量绿矾产品,配制成250.00mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000 mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。滴定时发生反应的离子方程式为:5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)。
①用硫酸酸化的0.01000 mol/LKMnO4溶液滴定时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 。
②判断此滴定实验达到终点的方法是 。
③若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省郴州市高三第二次月考理综化学试卷(解析版) 题型:填空题
(15分)CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为:
2NO(g)+2CO(g) N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H= +180.5kJ/mol ①
C(s)+O2(g)=CO2(g) △H= -393.5kJ/mol ②
2C(s)+O2=2CO(g) △H= -221kJ/mol ③
则 2NO(g) + 2CO(g) N2(g) + 2CO2(g)△H= 。
N2(g) + 2CO2(g)△H= 。
(2)-定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(NO)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的1/4。
①该反应的平衡常数K= (用只含a、V的式子表示)。
②判断该反应达到平衡的标志是____(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(3)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:

①有害气体NO的转化率是 ,0~15minCO2的平均反应速率v(CO2)=____。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是 (填序号)。
A.增加CO的量 B.加入催化剂
C.降低温度 D.扩大容积体积
(4)通过NOx传感器可监测NOx的含量,其工作原理如图所示,

则:
①Pt电极上发生的是 反应(填“氧化”或“还原”);
②NiO电极上的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省荆州市部分县市高三上学期期末统考理综化学试卷(解析版) 题型:选择题
常温时,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,该溶液pH一定为14-a
B.0.1mol/L的KHA溶液,其pH=10,c(K+)>c(A2-)>c(HA-) >c(OH-)
C.将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液: c(HA)>C(Na+)>c(A-)
D.等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省南阳市高三上学期期末理综化学试卷(解析版) 题型:填空题
(16分)已知在溶液中IO3-与I-、I2与S2O32-有如下反应:
IO3-+5I-+6H+=3I2+3H2O I2+2S2O32-=2I-+S4O62-
某课外活动小组为测定混有MgCl2的食用加碘盐中所含MgCl2、KIO3的含量,按下图所示实验步骤进行实验.

请回答下列问题:
(1)写出B和C的化学式:B________________,C________________。
(2)加入NaOH溶液必须稍过量的原因是________________________________。
(3)过滤用到的玻璃仪器有__________________________________________。
(4)该滴定实验所需仪器有下列中的_____________(填序号)
A.酸式滴定管
B.碱式滴定管
C.量筒
D.锥形瓶
E.铁架台
F.滴定管夹
G.烧杯
H.白纸
I.胶头滴管
J.漏斗
滴定时,判断滴定达到终点的现象是____________________________。
(5)MgCl2的质量分数是__________________________________________,KIO3的质量分数是_______________________________(列出计算式,可不化简)。
(6)使所测MgCl2的质量分数可能偏高的操作是_____________(填写字母)
A.过滤后未洗涤所得沉淀,直接烘干灼烧
B.在敞口容器中用托盘天平称量样品时,操作时间过长
C.沉淀灼烧不彻底
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省唐山市高三上学期期末理综化学试卷(解析版) 题型:选择题
【化学——选修5有机化学基础】(15分)
乙苯是一种重要的化工原料。以乙苯为原料通过以下转化可得多种化工产品。

己知:
I.
II.
III.A中苯环上的一氯代物只有2种
(1)写出物质A的分子式 ,M的结构简式: 。
(2)C中苯环侧链所含官能团的名称是 。
(3)E→F的反应类型是 。
(4)关于B的说法正确的是 。(填选项字母)
a.能发生银镜反应
b.能发生消去反应
c.遇FeCl3溶液发生显色反应
d.能与H2发生加成反应
(5)写出D→E反应的化学方程式: 。
(6)符合下列条件的A的同分异构体有____ 种(不考虑立体异构),写出任意一种同分异构体的结构简式: 。
①苯环上有3个取代基
②遇FeCl3溶液发生显色反应
③能与溴水发生加成反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三上学期期末化学试卷(解析版) 题型:选择题
下列实验结论正确的是
A.向某溶液中加入稀盐酸,产生的气体通人澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液
B.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定不含K+
C.将某气体通人溴水中,溴水颜色褪去,该气体一定是SO2
D.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省宁德市高三上学期期末化学试卷(解析版) 题型:填空题
(9分)4种短周期元素相对位置如下表。M元素既是构成生物体的基本元素,又是构成地壳中岩石和化石燃料的主要元素。回答下列问题:

(1)X的原子结构示意图为 。
(2)0.1 molQ的10电子氢化物与CuO反应生成Cu2O、H2O和Q单质时,生成Cu2O的物质的量是 。
(3)Y的氧化物与NaOH溶液反应的化学方程式是 。
(4)HR是含M元素的一元酸。常温下,0.1 mol·L-1 HR 溶液中,c(H+) = 1.3×10-3 mol·L-1。则HR  H++R-的电离平衡常数Ka= (保留一位小数)。
H++R-的电离平衡常数Ka= (保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com