�����ǻ�����������Ҫԭ��֮һ����������;�dz��㷺����һ�̶��ݻ�Ϊ2L���ܱ������ڼ���0.2mol��N
2��0.6mol��H
2���������·�Ӧ��N
2��g��+3H
2��g��?2NH
3��g��+Q��Q��0����
��1���÷�Ӧ���õĴ�����
����д���ƣ����÷�Ӧ450��ʱ��ƽ�ⳣ��
500��ʱ��ƽ�ⳣ�������������������=������
��2��������������˵��������Ӧ�Ѵ�ƽ�����
A��3V
����H
2��=2V
����NH
3��
B�������������ƽ������������ʱ����仯
C��������������ܶȲ���ʱ����仯
D������������ķ�����������ʱ����仯
��3��������Ӧ����5����ʱ�ﵽƽ�⣬���NH
3�����ʵ���Ϊ0.2mol����ӷ�Ӧ��ʼ��ƽ��ʱ��ƽ����Ӧ����v��N
2��Ϊ
��
��4������һ�ݻ��ɱ�������ڼ���0.2mol��N
2��0.6mol��H
2������ͬ�����·���������Ӧ���������NH
3�����ʵ�����ԭƽ�������NH
3
����ࡱ���١���һ��������
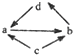
��5�����������İ�ˮϡ�ͺ�������ϣ�ϡ�Ͱ�ˮʱ������ˮ��������Һ�м��ٵ���
a��
b��
C��
d��
��6��Һ����ˮ���ƣ�Ҳ�ܵ��룺2NH
3?NH
4++NH
2-��ij�¶�ʱ�������ӻ�K=2��l0
-30�����¶��£��ٽ�����NH
4Cl�������Һ���У�K
=2��10
-30�����������������=�������ڽ�����������Ͷ��Һ���У���ȫ��Ӧ��������Һ�и�����Ũ�ȴ�С��ϵΪ��
��




 �����ǣ�������
�����ǣ�������