
【题目】下列除去杂质的实验方法正确的是( )
A.除去CO2中少量O2:用点燃的方法
B.除去NaCl溶液中的Na2SO4:加入适量Ba(NO3)2溶液后,过滤
C.除去Cu中的少量Fe:加入足量稀硫酸溶液后,过滤,洗涤,干燥
D.除去CO2中的少量HCl:通入NaOH溶液后,收集气体
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.铝粉投入到NaOH溶液中:2Al+2OH-= 2AlO2-+H2↑
B.铁和稀硝酸反应: Fe+2H+=Fe2++H2↑
C.AlCl3溶液中加入足量的氨水:Al3++ 3OH- = Al(OH)3↓
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2 = 2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如右图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2![]() C6+LiCoO2,下列说法不正确的是
C6+LiCoO2,下列说法不正确的是
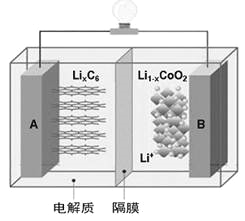
A. 据题意分析可知该隔膜只允许Li+通过,放电时Li+从左边移向右边
B. 放电时,正极锂的化合价未发生改变
C. 废旧钴酸锂电池进行“放电处理”让Li+进入石墨中而有利于回收
D. 充电时阳极的电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+
【答案】C
【解析】电解质是能传导Li+的高分子材料,所以隔膜只允许Li+通过,根据图示,A是负极,放电时Li+从左边移向右边,故A正确;放电时,正极Co元素化合价降低、锂的化合价未发生改变,故B正确;“放电处理”,Li+进入Li1-xCoO2中,故C错误;充电时阳极失电子发生氧化反应,电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+,故D正确。
点睛:原电池中负极失电子发生氧化反应,正极得电子发生还原反应;电解质溶液中阳离子移向正极、阴离子移向负极。
【题型】单选题
【结束】
7
【题目】下列溶液中各微粒的浓度关系正确的是
A. 0.2 mol·L-1的Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
B. pH相等的NaF与CH3COOK溶液:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)]
C. pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液,NH4+大小顺序为①=②>③
D. 0.2 mol·L-1HCl与0.1 mol·L-1NaAlO2溶液等体积混合:c(Cl-)>c(Na+)>c(H+)>c(Al3+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将 2molSO2 和 1molO2 通入体积为 2L 的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ,△H=-196.6kJ/mol. 2min 时反应达到化学平衡,此时测得反应物O2 还剩余 0.8mol,请填写下列空白:
2SO3(g) ,△H=-196.6kJ/mol. 2min 时反应达到化学平衡,此时测得反应物O2 还剩余 0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成 SO3 的平均反应速率为__________ ;平衡时,SO2 转化率为_____________
(2)下列叙述能证明该反应已达到化学平衡状态的是 __________
A.容器内压强不再发生变化 B.SO2 的体积分数不再发生变化
C.容器内气体原子总数不再发生变化 D.相同时间内消耗 2nmolSO2 的同时消耗 nmolO2
E.相同时间内消耗 2nmolSO2 的同时生成 nmolO2 F.混合气体密度不再变化
(3)以下操作会引起化学反应速率变快的是__________
A.向容器中通入O2 B.扩大容器的体积 C.使用正催化剂
D.升高温度 E.向容器中通入氦气。
(4)t2℃时,若将物质的量之比 n(SO2) :n(O2)=1:1 的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了 20%。则SO2 的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料的应用推动了城市发展,很多方面涉及到了化学反应,认真回答下列问题:
(1)我国早在春秋战国就开始生产和使用铁器,写出用赤铁矿为原料炼铁的化学方程式:___________________。
(2)氢氧化钾是我国古代纺织业常用的漂洗洗涤剂,古人将贝壳(主要成分是碳酸钙)灼烧后的固体与草木灰(主要成分是碳酸钾)在水中相互作用,便可得到氢氧化钾。请按要求用化学方程式表示上述反应:分解反应:___________,化合反应:_____________,复分解反应:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种固体物质溶解度曲线如图所示。请回答:
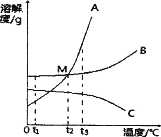
(1)图中M点表示_________________;
(2)t3℃时A、B、C三种物质的溶解度由小到大的顺序是____________;
(3)现有t1℃时A、B、C的三种饱和溶液,分别将它们升温到t3℃,溶质的质量分数由大到小的顺序是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol某烃在氧气中充分燃烧,需要消耗氧气179.2L(标准状况),它在光照条件下与氯气反应能生成3种不同的一氯代物。则该烃的结构简式是
A. 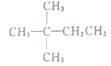 B. CH3CH2CH2CH2CH3
B. CH3CH2CH2CH2CH3
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 常温常压下,48g O3含有的氧原子数为3NA
B. 标准状况下,22.4L Cl2与足量的Fe反应转移的电子数为3NA
C. 已知可逆反应:2NO2![]() N2O4,将2molNO2放入反应容器中,生成的N2O4的物质的量一定是1mol
N2O4,将2molNO2放入反应容器中,生成的N2O4的物质的量一定是1mol
D. 58.5gNaCl固体溶于1L的水中,所得溶液的物质的量浓度为1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在实验室使用软锰矿(主要成分为MnO2)和浓盐酸通过加热制备氧气,并对氯气的性质进行探究。
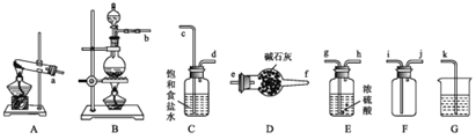
(1)写出实验室制氯气的化学方程式________。欲制取并收集一瓶干燥的氯气,则“制取→收集”的实验装置连接顺序为:____→c→d→_____→i→j→k
(2)装置C中饱和食盐水的作用是______________。
(3)该小组同学对氯气性质进行如下探究:
实验步骤 | 实验结论 |
①将氯气通入到NaCl溶液中,再加入1mL CCl4振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序: 氯、溴、碘 |
②将氯气通入到KBr溶液中,再加入1mL CCl4振荡,静置,观察四氯化碳层颜色 | |
③将氯气通入到KI溶液中,再加入1mL CCl4振荡,静置,观察四氧化碳层颜色 |
该小组的实验设计缺陷是___________,改进的办法是________________。
(4)常温下,高锰酸钾固体和浓盐酸反应也可制得氯气,该反应的离子方程式为______________。
(5)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的质量之比为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com