
【题目】材料的应用推动了城市发展,很多方面涉及到了化学反应,认真回答下列问题:
(1)我国早在春秋战国就开始生产和使用铁器,写出用赤铁矿为原料炼铁的化学方程式:___________________。
(2)氢氧化钾是我国古代纺织业常用的漂洗洗涤剂,古人将贝壳(主要成分是碳酸钙)灼烧后的固体与草木灰(主要成分是碳酸钾)在水中相互作用,便可得到氢氧化钾。请按要求用化学方程式表示上述反应:分解反应:___________,化合反应:_____________,复分解反应:_____________。
【答案】Fe2O3+3CO 高温 2Fe+3CO2CaCO3 高温 CaO + CO2↑CaO+ H2O=Ca(OH)2Ca(OH)2 + K2CO3= CaCO3↓+ 2KOH
【解析】
(1)赤铁矿主要成分为氧化铁,高温下被一氧化碳还原为铁。
(2)根据已有的知识结合题干提供的信息进行分析,碳酸钙能高温分解生成氧化钙和二氧化碳,氧化钙能与水化合生成氢氧化钙,氢氧化钙能与碳酸钾反应生成氢氧化钾和碳酸钙沉淀。
(1)赤铁矿主要成分为氧化铁,高温下被一氧化碳还原为铁,反应的方程式为:![]() ;正确答案:
;正确答案:![]() 。
。
(2)碳酸钙能高温分解生成氧化钙和二氧化碳, ![]() ;氧化钙能与水化合生成氢氧化钙为化合反应:CaO+H2O=Ca(OH)2;氢氧化钙与碳酸钾反应生成碳酸钙和氢氧化钾为复分解反应:Ca(OH)2+K2CO3=CaCO3↓+ 2KOH;正确答案:
;氧化钙能与水化合生成氢氧化钙为化合反应:CaO+H2O=Ca(OH)2;氢氧化钙与碳酸钾反应生成碳酸钙和氢氧化钾为复分解反应:Ca(OH)2+K2CO3=CaCO3↓+ 2KOH;正确答案:![]() ;CaO+ H2O=Ca(OH)2 ;Ca(OH)2 +K2CO3= CaCO3↓+ 2KOH。
;CaO+ H2O=Ca(OH)2 ;Ca(OH)2 +K2CO3= CaCO3↓+ 2KOH。


科目:高中化学 来源: 题型:
【题目】常温下,在下列溶液中可能大量共存的离子组是
A. pH=0的溶液:Fe2+、Mg2+、NO3-、SO42-
B. 由水电离出的c(H+)=1×10-13 mol/L的溶液:Al3+、K+、SO42-、Cl-
C. c (OH-)/c(H+)=1012的溶液中:Na+、SO42-、NO3-、HCO3-
D. 滴加KSCN变红色的溶液:Na+、K+、Al3+、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①9.8gH2SO4的物质的量为_____mol,约含有_____个H2SO4分子。
②标准状况下,22.4LH2的质量为______g。
③将30mL0.5mol/LNaCl溶液加水稀释到500mL,稀释后NaCl溶液的物质的量浓度为__________mol/L。
④摩尔质量的符号为_______,单位是__________(符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列配制的溶液浓度偏高的是( )
A.配制硫酸用量筒量取硫酸时俯视刻度线
B.配制盐酸定容时,仰视容量瓶刻度线
C.NaOH溶解后未经冷却即注入容量瓶至刻度线
D.称量4gNaOH配制0.1mol/L NaOH溶液1000mL时,砝码错放左盘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某主族元素的离子X2+有6个电子层,最外层有2个电子,当把XO2溶于浓盐酸时,有黄色气体产生,则下列说法不正确的是
A. X2+具有还原性 B. X的+2价化合物比+4价化合物稳定
C. XO2具有强氧化性 D. 该元素是第ⅡA族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的实验方法正确的是( )
A.除去CO2中少量O2:用点燃的方法
B.除去NaCl溶液中的Na2SO4:加入适量Ba(NO3)2溶液后,过滤
C.除去Cu中的少量Fe:加入足量稀硫酸溶液后,过滤,洗涤,干燥
D.除去CO2中的少量HCl:通入NaOH溶液后,收集气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为:
![]()
【提出假设】假假设1: 该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3: K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是___________________________________________
【设计、完成实验】
(1)称取_______g草酸晶体(H2C2O4·2H2O),配置500mL 0.10mol/L H2C2O4溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和___________________________。
②下列操作会使所配溶液浓度偏低的是_______(填下列选项的字母序号)。
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘
B.定容时俯视刻度线
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
(2)完成探究,记录数据
实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
0.10mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | 水浴控制温度65℃ | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
4 | 30 | 20 | x | 20 | 加入5mL 0.10mol/L K2SO4溶液 | 18 |
则x =________________,假设___________成立
(3)由于KMnO4能氧化水中有机物等因素,配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定并记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,
判断滴定终点的现象为_____________________________。上述实验中KMnO4溶液的物质的量浓度为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习物质结构和性质的重要工具,下图是元素周期表的一部分,表中所列字母A、D、F、G、Q、M、R、N、T分别代表某种化学元素。请依据这9种元素回答下列问题。
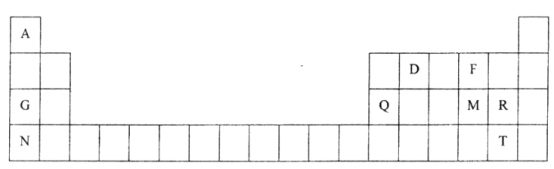
(1)以上9种元素中金属性最强的元素是_______(填元素符号)。
(2)元素的非金属性:M______R(填“>”或“<”)。
(3)R的最高价氧化物对应水化物的化学式是_____________。
(4)F、G两元素形成的淡黄色固体物质的电子式为_____________。
(5)表中M、R、N元素可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是_____________(用离子符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com