
(14分)无机物A是一种固体,熔点178℃,30℃以下为浅黄色。经测定A(相对分子质量为184)含两种元素,原子个数比为1:1。隔绝空气迅速加热A将发生爆炸,爆炸后残留物B呈淡黄色。该淡黄色物质在空气中加热会燃烧并产生刺激性气味。在一定条件下,6.18g液体SCl2和2.72g气体C恰好完全反应生成A和单质B及6.42克化合物D。加热D发现无任何物质存在,把D溶于水测得溶液的pH小于7。已知气体C在标准状况下的密度为0.76g·L-1。
(1)A的化学式为 ,C的电子式 。
(2)写出SCl2和气体C反应的化学方程式 。
(3)1molSCl2能与2mol乙烯发生加成反应生成一种化学毒气芥子气,写出发生反应的化学方程式 。
(4)亚硝酸钠和D固体在加热条件下 (填“可能”或“不能”)发生反应,判断理由是 。
(5)请设计检验物质D的实验方案 。
(1)N4S4, 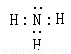 ;(2)6SCl2+16NH3= N4S4+2S+12NH4Cl;
;(2)6SCl2+16NH3= N4S4+2S+12NH4Cl;
(3)SCl2+2CH2=CH2→Cl—CH2—CH2—S—CH2—CH2—Cl ;
(4) 可能; NaNO2中的氮的化合价为+3价,NH4Cl中的氮的化合价为-3价,因而有可能发生氧化还原反应生成氮气 ;
(5)取少量D固体加水溶解,分成两份。其中一份与NaOH溶液混合加热,若产生使湿润的红色石蕊试纸变蓝的气体则证明有NH4+;另一份溶液中加入硝酸酸化的AgNO3溶液,若出现白色沉淀,则证明有Cl-离子。
【解析】
试题分析:(1)隔绝空气迅速加热A将发生爆炸,爆炸后残留物单质B呈淡黄色。该淡黄色物质在空气中加热会燃烧并产生刺激性气味气体,则B是S单质。在标准状况下C的的密度为0.76g·L-1,则C的摩尔质量是0.76g/L×22.4L/mol=17g/mol。则C为NH3.其电子式为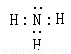 。n(SCl2)= 6.18g÷103g/mol=0.06ml;n(NH3)= 2.72g÷17g/mol=0.16mol。加热化合物D发现无任何物质存在,把D溶于水测得溶液的pH小于7。根据元素守恒可得D为NH4Cl。n(NH4Cl)= 6.42g÷53.5g/mol=0.12mol。所以在物质A中含有N:0.04mol,含有H:0.16×3-0.12×4=0mol。A含两种元素,原子个数比为1:1,因此另一种元素是S,设其化学式是(SN)n。因为相对分子质量为184,所以46n=184,因此n=4.A的化学式为N4S4。(2)因为n(NH3)= 0.16mol;n(NH4Cl)= 0.12mol。则A物质含有N原子0.04mol,所以A的物质的量为0.01mol.,产生的S单质的物质的量为0.06ml=0.04mol=0.02mol。根据生成的物质结合元素守恒可得SCl2和氨气反应的方程式为6SCl2+16NH3= N4S4+2S+12NH4Cl;(3)根据题意及物质间的物质的量关系可得方程式为SCl2+2CH2=CH2→Cl—CH2—CH2—S—CH2—CH2—Cl ;(4)由于在亚硝酸钠中N的化合价为+3价,在NH4Cl中N的化合价为-3价,所以根据氧化还原反应的规律,二者在加热条件下能够发生反应。产生中间价态的物质氮气。(5)离子的检验方法是取少量D固体加水溶解,分成两份。其中一份与NaOH溶液混合加热,若产生使湿润的红色石蕊试纸变蓝的气体则证明有NH4+;另一份溶液中加入硝酸酸化的AgNO3溶液,若出现白色沉淀,则证明有Cl-离子。
。n(SCl2)= 6.18g÷103g/mol=0.06ml;n(NH3)= 2.72g÷17g/mol=0.16mol。加热化合物D发现无任何物质存在,把D溶于水测得溶液的pH小于7。根据元素守恒可得D为NH4Cl。n(NH4Cl)= 6.42g÷53.5g/mol=0.12mol。所以在物质A中含有N:0.04mol,含有H:0.16×3-0.12×4=0mol。A含两种元素,原子个数比为1:1,因此另一种元素是S,设其化学式是(SN)n。因为相对分子质量为184,所以46n=184,因此n=4.A的化学式为N4S4。(2)因为n(NH3)= 0.16mol;n(NH4Cl)= 0.12mol。则A物质含有N原子0.04mol,所以A的物质的量为0.01mol.,产生的S单质的物质的量为0.06ml=0.04mol=0.02mol。根据生成的物质结合元素守恒可得SCl2和氨气反应的方程式为6SCl2+16NH3= N4S4+2S+12NH4Cl;(3)根据题意及物质间的物质的量关系可得方程式为SCl2+2CH2=CH2→Cl—CH2—CH2—S—CH2—CH2—Cl ;(4)由于在亚硝酸钠中N的化合价为+3价,在NH4Cl中N的化合价为-3价,所以根据氧化还原反应的规律,二者在加热条件下能够发生反应。产生中间价态的物质氮气。(5)离子的检验方法是取少量D固体加水溶解,分成两份。其中一份与NaOH溶液混合加热,若产生使湿润的红色石蕊试纸变蓝的气体则证明有NH4+;另一份溶液中加入硝酸酸化的AgNO3溶液,若出现白色沉淀,则证明有Cl-离子。
考点:考查物质的分子式、电子式和反应的方程式的书写、离子的检验、化学式的推断的知识。


科目:高中化学 来源:2013-2014湖北省大冶市春季期末考试高二化学试卷(解析版) 题型:选择题
下列离子方程式表达正确的是( )
A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
B.小苏打溶液呈碱性的原因:HCO3-+H2O H3O++CO32-
H3O++CO32-
C.溴化亚铁溶液中通入足量氯气:2Fe2++ 4Br-+ 3Cl2 = 2Fe3++2 Br2 + 6Cl-
D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液:
NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3·H2O+2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014海口市第二学期高二化学期中考试(B卷)试卷(解析版) 题型:选择题
下列有机物检验方法正确的是( )
A.取少量卤代烃加入NaOH水溶液共热,冷却,再加入AgNO3溶液检验卤代烃中卤原子的存在
B.用酸性KMnO4溶液直接检验乙醇与浓硫酸反应是否得到乙烯
C.用燃烧的方法鉴别甲烷与乙炔
D.用新制CaO检验乙醇中是否含有水分
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高三下学期联考理综化学试卷(解析版) 题型:填空题
(15分)二甲醚(DME)和甲醇是21世纪应用最广泛的两种清洁燃料,目前工业上均可由合成气在特定催化剂作用下制得。
(1)由合成气制备二甲醚的主要原理如下:
已知:①CO(g)+2H2(g) CH3OH(g) △H1=-90.7 kJ·mol-1
CH3OH(g) △H1=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
则反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
(2)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:
4H2(g)+2CO(g) CH3OCH3(g)+H2O(g),其中CO的平衡转化率随温度、压强变化关系如图所示:
CH3OCH3(g)+H2O(g),其中CO的平衡转化率随温度、压强变化关系如图所示:
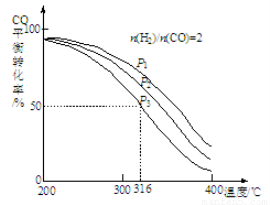
①该反应的平衡常数表达式为 ;P1、P2、P3由大到小的顺序为 。
②若反应在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO的转化率 50%(填“大于”、“小于”或“等于”)。
(3)由合成气合成甲醇的反应的温度与平衡常数(K)的关系如表数据,

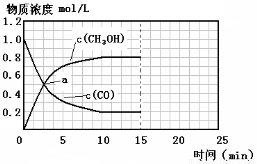
250℃时,将2 molCO和6 molH2充入2L的密闭容器中发生反应,反应时间与物质浓度的关系如图所示,则前10分钟内,氢气的平均反应速率为 ;若15分钟时,只改变温度一个条件,假设在20分钟时达到新平衡,氢气的转化率为33.3%,此时温度为 (从上表中选),请在图中画出15—25分钟c (CH3OH)的变化曲线。
(4)利用甲醇液相脱水也可制备二甲醚,原理是:CH3OH +H2SO4→CH3HSO4+H2O,CH3HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高三下学期联考理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.金属汞一旦洒落,必须尽可能收集起来,放在水中保存以防挥发;并将硫磺粉撒在洒落的地方,使金属汞转变成不挥发的硫化汞
B.胶状沉淀和颗粒太小的沉淀不能用抽滤的原因是在快速过滤时沉淀易透过滤纸
C.用移液管吸取溶液后,将移液管垂直放入稍倾斜的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管
D.将水杨酸、乙酸酐和浓硫酸在锥形瓶中混合后,水浴加热,一段时间后取出锥形瓶,为使阿司匹林完全结晶需向锥形瓶中加适量的水,并将锥形瓶置于冰水浴中
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省湖州市高三二模理综化学试卷(解析版) 题型:选择题
元素X、Y、Z、W的原子序数依次增大,且原子序数之和为22,最外层电子数之和为16,在化合物Y2X2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构。下列说法正确的是
A.X、Y、Z、W的原子半径的大小关系为:W> Y >Z> X
B.在化合物Y2X2、Z2X4、X2W2中,分子所含的共用电子对数相等
C.与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键
D.X、Y、Z、W四种元素可形成化学式为X7Y2ZW2的化合物
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省温州市业水平考试适应性测试化学试卷(解析版) 题型:推断题
(4分)已知:A是石油裂解气的主要成分,现以A为主要原料合成乙酸乙酯,其合成路线如图所示。请回答下列问题:

(1) B物质中官能团的名称____________。
(2) 写出反应③的化学方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省温州市业水平考试适应性测试化学试卷(解析版) 题型:选择题
下列反应中,不属于取代反应范畴的有
A.CH4+Cl2  CH3Cl+HCl
CH3Cl+HCl
B.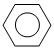 +HNO3
+HNO3 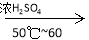
 +H2O
+H2O
C.2CH3CH2OH+O2 2CH3CHO+2H2O
2CH3CHO+2H2O
D.CH3COOCH2CH3+H2O  CH3COOH+CH3CH2OH
CH3COOH+CH3CH2OH
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高一下学期期中化学试卷(解析版) 题型:选择题
(9分)在2 L密闭容器内,800℃时反应2SO2(g)+O2(g) 2SO3(g)体系中,n(SO2)随时间的变化如下表:
2SO3(g)体系中,n(SO2)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)(mol) | 0.020 | 0. 010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应,在第 5 s时,SO2的转化率为________;
(2)如图所示,表示SO3变化曲线的是_____,用O2表示从0 s~2 s内该反应的平均速率:v=__;
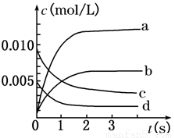
(3)能说明该反应已达到平衡状态的是________。
a.v(SO3)=2v(O2) b.混合气体中SO2的体积分数保持不变
c.v逆(SO2)=2v正(O2) d.容器内密度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com