
(15分)二甲醚(DME)和甲醇是21世纪应用最广泛的两种清洁燃料,目前工业上均可由合成气在特定催化剂作用下制得。
(1)由合成气制备二甲醚的主要原理如下:
已知:①CO(g)+2H2(g) CH3OH(g) △H1=-90.7 kJ·mol-1
CH3OH(g) △H1=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
则反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
(2)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:
4H2(g)+2CO(g) CH3OCH3(g)+H2O(g),其中CO的平衡转化率随温度、压强变化关系如图所示:
CH3OCH3(g)+H2O(g),其中CO的平衡转化率随温度、压强变化关系如图所示:
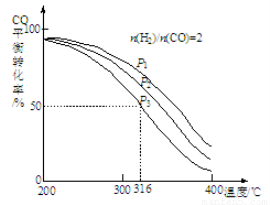
①该反应的平衡常数表达式为 ;P1、P2、P3由大到小的顺序为 。
②若反应在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO的转化率 50%(填“大于”、“小于”或“等于”)。
(3)由合成气合成甲醇的反应的温度与平衡常数(K)的关系如表数据,

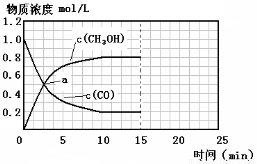
250℃时,将2 molCO和6 molH2充入2L的密闭容器中发生反应,反应时间与物质浓度的关系如图所示,则前10分钟内,氢气的平均反应速率为 ;若15分钟时,只改变温度一个条件,假设在20分钟时达到新平衡,氢气的转化率为33.3%,此时温度为 (从上表中选),请在图中画出15—25分钟c (CH3OH)的变化曲线。
(4)利用甲醇液相脱水也可制备二甲醚,原理是:CH3OH +H2SO4→CH3HSO4+H2O,CH3HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是 。
(1)-246.1;
(2)①K=[CH3OCH3][H2O]/ [H2]4[CO]2; P1>P2>P3;②大于;
(3)0.16mol/(L?min);300℃;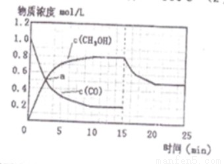 ;
;
(4)硫酸是强酸,具有较强的腐蚀性,能腐蚀设备。
【解析】
试题分析:(1)①CO(g)+2H2(g) CH3OH(g) △H1=-90.7 kJ·mol-1
CH3OH(g) △H1=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
根据盖斯定律,①×2+②+③得3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)△H=-246.1kJ?mol-1;(2)①根据反应4H2(g)+2CO(g)
CH3OCH3(g)+CO2(g)△H=-246.1kJ?mol-1;(2)①根据反应4H2(g)+2CO(g) CH3OCH3(g)+H2O(g)知,该反应的平衡常数表达式K=[CH3OCH3][H2O]/ [H2]4[CO]2;该反应正方向为体积减小的方向,增大压强CO的转化率增大,结合题给图像知,P1>P2>P3;②若在P3和316℃时,起始时起始时n(H2)/n(CO)=3,则增大了氢气的量,增大氢气的浓度,平衡正移,CO的转化率增大,所以CO转化率大于50%;(3)由题给图像知,甲醇的浓度变化为0.8mol/L, V(CH3OH)=△c/△t=0.08mol/(L?min),根据方程式得V(CH3OH):V(H2)=1:2,所以V(H2)=2×0.08mol/(L?min)=0.16mol/(L?min);改变温度,假设在20分钟时达到新平衡,氢气的转化率为33.3%,则氢气转化的浓度为△C=3mol/L×33.3%=1mol/L,
CH3OCH3(g)+H2O(g)知,该反应的平衡常数表达式K=[CH3OCH3][H2O]/ [H2]4[CO]2;该反应正方向为体积减小的方向,增大压强CO的转化率增大,结合题给图像知,P1>P2>P3;②若在P3和316℃时,起始时起始时n(H2)/n(CO)=3,则增大了氢气的量,增大氢气的浓度,平衡正移,CO的转化率增大,所以CO转化率大于50%;(3)由题给图像知,甲醇的浓度变化为0.8mol/L, V(CH3OH)=△c/△t=0.08mol/(L?min),根据方程式得V(CH3OH):V(H2)=1:2,所以V(H2)=2×0.08mol/(L?min)=0.16mol/(L?min);改变温度,假设在20分钟时达到新平衡,氢气的转化率为33.3%,则氢气转化的浓度为△C=3mol/L×33.3%=1mol/L,
2H2(g)+CO(g) CH3OH(g)
起始浓度(1mol/L) 3 1 0
转化浓度(1mol/L) 1 0.5 0.5
平衡浓度(1mol/L) 2 0.5 0.5
K=0.25,所以该温度为300℃;由反应CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ?mol-1,该反应为吸热反应,温度升高平衡向移动,甲醇含量减小,图象见答案;(4)该反应有硫酸参加,因为硫酸是强酸,具有较强的腐蚀性,能腐蚀设备。
考点:考查热化学方程式和盖斯定律计算应用,平衡常数的计算及应用,影响平衡的因素。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源:2013-2014湖北省大冶市春季期末考试高二化学试卷(解析版) 题型:填空题
(8分)有一瓶澄清的溶液,其中可能含有NH4+、K+、 Ba2+、Al3+、Fe3+、 I-、NO3-、CO32-、SO42-、AlO2- 。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性。
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色。
③另取溶液适量,逐滴加入NaOH溶液:a.溶液从酸性变为中性;b.溶液逐渐产生沉淀;c.沉淀完全溶解;d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
④取适量③得到的碱性溶液加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题。
(1)由①可以排除 离子的存在。
(2)由②可以证明 离子的存在,同时排除 离子存在。理由是_________________________。
(3)由③可证明 离子存在。
(4)由④可以排除 离子存在,同时证明 离子的存在。
查看答案和解析>>
科目:高中化学 来源:2013-2014海口市第二学期高二化学期中考试(B卷)试卷(解析版) 题型:填空题
(13分)有机合成中增长碳链是一个重要环节。如下列反应:
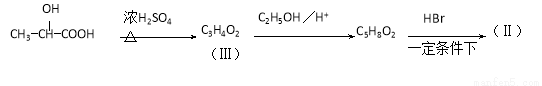
用  通过以下路线可合成(Ⅱ):
通过以下路线可合成(Ⅱ):
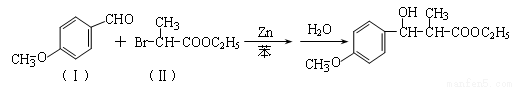
(1)(Ⅰ)的分子式为 ;(Ⅲ)的结构简式为 。
(2)(Ⅱ)与足量的热NaOH溶液反应的化学方程式为 。
(3) 在生成(Ⅲ)时,还能得到另一种副产物C6H8O4,该反应的化学方程式为 ,反应类型是 。
在生成(Ⅲ)时,还能得到另一种副产物C6H8O4,该反应的化学方程式为 ,反应类型是 。
(4)(Ⅰ)的一种同分异构体(Ⅳ)能发生银镜反应,还能水解生成不含甲基的芳香化合物。(Ⅳ)的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省绍兴市柯桥区高三第二次模拟考试理综化学试卷(解析版) 题型:实验题
(15分)浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度。COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量。某学习小组用重铬酸钾法测定某水样中的COD。主要的实验装置、仪器及具体操作步骤如下:
实验装置及仪器:

操作步骤:
①用仪器c将20.00mL水样置于250mL锥形瓶中,加入数粒碎瓷片。
②在水样中加入重铬酸钾标准溶液10.00mL,安装回流装置(如上图所示),从冷凝管上口加入30.00mL的H2SO4—Ag2SO4溶液,混匀后加热回流2h,充分反应。
③冷却后加指示剂2d,用硫酸亚铁铵溶液滴定多余重铬酸钾,至溶液由绿色变成红褐色。
已知:Cr2O72—+14H++6Fe2+=6Fe3++2Cr3++7H2O
请你回答下列问题:
(1)仪器c的名称: ;用仪器c吸取液体时,左手拿洗耳球,右手将仪器c插入溶液中吸取,当 时,立即用食指将管口堵住,将管尖离开液面,稍松食指使液面平稳下降,至凹液面最低处与标线相切,立即按紧管口。
(2)下列有关操作不正确的是 (用相应编号填写)
A.用硫酸亚铁铵溶液滴定时需上述仪器中的仪器b
B. 仪器c在使用时需要先用待取液进行润洗,管尖残留的液体一般不要吹出
C.加入数粒碎瓷片的作用是可以防止液体暴沸
D.上述操作步骤③中在滴定时判断滴定终点的指示剂可以是甲基橙
E.加热回流结束后,要用蒸馏水对冷凝管管壁进行冲洗
(3)在加热回流过程中,可以用水浴作为恒温加热源吗?同时请说明理由。
(4)下列因素对测定水样中的COD能产生影响的有 (用相应编号填写)
①硫酸的用量 ②反应装置中的锥形瓶在反应前用蒸馏水洗涤
③重铬酸钾的用量 ④回流时间的长短
(5)实验室配制重铬酸钾标准溶液的主要步骤及装置如下所示:

将上述实验步骤A到F按实验过程先后次序排列
(6)已知:重铬酸钾标准溶液的c(Cr2O72—)=0.0250mol·L—1,硫酸亚铁铵溶液的c(Fe2+)=0.0100 mol·L—1,滴定终点时所消耗的硫酸亚铁铵溶液的体积为12.00mL,则按上述实验方法,测得的该水样的化学需氧量CODCr(O2)= mg/L
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省绍兴市柯桥区高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.某芳香烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种
B. 将 转化为
转化为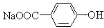 的方法是加入足量的NaOH溶液并加热, 再通入足量的CO2
的方法是加入足量的NaOH溶液并加热, 再通入足量的CO2
C.1mol某有机物的结构简式为  ,通过消去反应脱去1 molHCl时,能得到 5 种不同产物(不考虑立体异构)
,通过消去反应脱去1 molHCl时,能得到 5 种不同产物(不考虑立体异构)
D.等质量的甲烷、乙烯、1,3-丁二烯(C4H6)分别充分燃烧,所耗用氧气的量依次减少
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高三下学期联考理综化学试卷(解析版) 题型:选择题
钛被称为21世纪金属。研究发现,用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图所示装置制备金属钛。下列叙述正确的是

A.乙装置阴极的电极反应式为
TiO2+4e-=Ti+2O2-
B.若不考虑能量的损失,制备24.0g
金属钛,需要消耗金属铝36.0g
C.甲装置工作过程中OH-向AgO/Ag极移动;乙装置工作过程中O2-向钛网移动
D.乙装置中的石墨电极需要定期更换
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省湖州市高三二模理综化学试卷(解析版) 题型:填空题
(14分)无机物A是一种固体,熔点178℃,30℃以下为浅黄色。经测定A(相对分子质量为184)含两种元素,原子个数比为1:1。隔绝空气迅速加热A将发生爆炸,爆炸后残留物B呈淡黄色。该淡黄色物质在空气中加热会燃烧并产生刺激性气味。在一定条件下,6.18g液体SCl2和2.72g气体C恰好完全反应生成A和单质B及6.42克化合物D。加热D发现无任何物质存在,把D溶于水测得溶液的pH小于7。已知气体C在标准状况下的密度为0.76g·L-1。
(1)A的化学式为 ,C的电子式 。
(2)写出SCl2和气体C反应的化学方程式 。
(3)1molSCl2能与2mol乙烯发生加成反应生成一种化学毒气芥子气,写出发生反应的化学方程式 。
(4)亚硝酸钠和D固体在加热条件下 (填“可能”或“不能”)发生反应,判断理由是 。
(5)请设计检验物质D的实验方案 。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省温州市业水平考试适应性测试化学试卷(解析版) 题型:选择题
下列与试验操作相关的描述中,正确的是
A.制乙酸乙酯时,迅速将乙醇注入浓硫酸中
B.在石油蒸馏装置中,将温度计水银球插入液面以下
C.用铂丝蘸取少量KCl溶液置于火焰上灼烧,直接观察火焰颜色,检验K+的存在
D.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高二下学期期中化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是 ( )
A.向银氨溶液中滴加乙醛:
CH3CHO +2[Ag(NH3)2]+ + H2O CH3COO- + NH4+ +3NH3 + 2Ag↓+2H+
CH3COO- + NH4+ +3NH3 + 2Ag↓+2H+
B.苯酚钠溶液中通入少量CO2: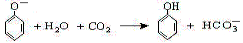
C.硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3·H2O+H2O
D.氯乙酸与足量的氢氧化钠溶液共热:CH2ClCOOH+OH—△CH2ClCOO—+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com