
һ���¶��£���4���ݻ���Ϊ1 L�ĺ��������зֱ���з�Ӧ(��������A��������A(s)+B(g�� C(g)+D(g�� ��H ="+100" kJ��mol-1��ijʱ�̲�ò����������±���
C(g)+D(g�� ��H ="+100" kJ��mol-1��ijʱ�̲�ò����������±���
| ������� | n(B)/mol | n(C)/mol | n(D)/mol | ��Ӧʱ��/min | ��Ӧ���� |
| �� | 0��06 | 0��60 | 0��10 | t1 | v(��)=v(��) |
| �� | 0��12 | 1��20 | 0��20 | t2 | |
| �� | 0��32 | 1��0 | 0 | 0 | |
| �� | 0��12 | 0��30 | | | v(��)=v(��) |
D
�������������A����ѧ��Ӧ���ʵ��ڵ�λʱ��������Ũ�ȵĸı�ֵ��ֻ֪��ijʱ�̸����������ʵ���������֪�������ʵ����ĸı���ֵ�������������䷴Ӧ���ʡ�����B��t2ʱ�����������ڲ������Ӧ���еķ���������ȷ��v(��)��v(��)����Դ�С������C���������з�Ӧ��ʲô����ʼ�������������ȷ���ﵽƽ��ʱ���ȵĶ��١�����D���������������������ж���ͬһ�¶��µ�ƽ��״̬������K��ȡ�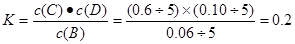 ������
������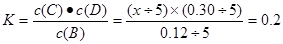 ���x="c(D)=" 0��4 mol��L-1����ȷ��
���x="c(D)=" 0��4 mol��L-1����ȷ��
���㣺���黯ѧƽ�ⳣ�������ʵ�ƽ��Ũ�ȵĹ�ϵ��֪ʶ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ�ܱ���ƿ��ע��NO2����25��ʱ��������ƽ�⣺2NO2 N2O4������ӦΪ���ȷ�Ӧ����������ƿ����100��ķ�ˮ�У��������������ɫ����ƽ����Է�������������������ѹǿ�����ܶȡ����в������
N2O4������ӦΪ���ȷ�Ӧ����������ƿ����100��ķ�ˮ�У��������������ɫ����ƽ����Է�������������������ѹǿ�����ܶȡ����в������
| A���ڢ� | B���ۢ� | C���ۢ� | D���٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
һ�������£������Ϊ10 L�Ĺ̶������з�����Ӧ��N2(g)��3H2(g)  2NH3(g)����H��0����Ӧ������ͼ������˵����ȷ����
2NH3(g)����H��0����Ӧ������ͼ������˵����ȷ����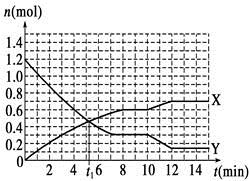
| A��t1minʱ�����淴Ӧ������� |
| B��X���߱�ʾNH3�����ʵ�����ʱ��仯�Ĺ�ϵ |
| C��0��8 min��H2��ƽ����Ӧ����v(H2)��mol��L��1��min��1 |
| D��10��12 min��N2��ƽ����Ӧ����v(N2)��0.25 mol��L��1��min��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�Կ��淴Ӧ4NH3��g��+ 5O2��g�� 4NO��g��+ 6H2O��g��������������ȷ���ǣ� ��
4NO��g��+ 6H2O��g��������������ȷ���ǣ� ��
| A���ﵽ��ѧƽ��ʱ��4������O2��= 5������NO�� |
| B������λʱ��������x mol NO��ͬʱ������x mol NH3 ����Ӧ�ﵽƽ��״̬ |
| C���ﵽ��ѧƽ��ʱ�����������������������Ӧ���ʼ��٣��淴Ӧ�������� |
| D����ѧ��Ӧ���ʹ�ϵ�ǣ�2������NH3��= 3������H2O�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
һ���¶��£���ӦA2(g)��B2(g)??2AB(g)�ﵽƽ��ı�־��( )
| A����λʱ��������n mol A2��ͬʱ����n mol AB |
| B�������ڵ���ѹǿ����ʱ��ı仯���仯 |
| C����λʱ��������2n mol AB��ͬʱ����n mol B2 |
| D����λʱ��������n mol A2��ͬʱ����n mol B2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪��ӦA(g)��3B(g)=2C(g)��D(g)��ij��ʱ������A��Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ����Ϊ1 mol/(L��min)����˶�ʱ������C��Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ����Ϊ�� ��
| A��0.5 mol/(L��min) | B��1 mol/(L��min) |
| C��2 mol/(L��min) | D��3 mol/(L��min) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��Ʒ�Һ��Cr2O72-��ͨ�����з�Ӧת���ɸ���(PbCrO4)��Cr2O72-(aq)��2Pb2��(aq)��H2O(l)??2PbCrO4(s)��2H��(aq) ��H<0�÷�Ӧ��ƽ��ı�������ʾ�ķ�Ӧ����������ʾ��ͼ��ȷ����( )
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���б����еĸ����������������ͼ��ʾ���߱�ʾ����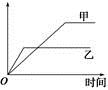
| ѡ�� | ��Ӧ | ������ | �� | �� |
| A | ��ͬ�����İ�������ͬһ�����з�����Ӧ��2NH3 N2��3H2 N2��3H2 | ������ת���� | 500 �� | 400 �� |
| B | �������ļء��Ʒֱ���������ˮ��Ӧ | H2������ | �� | �� |
| C | ������ɱ�ĺ�ѹ�����У����֮��Ϊ1��3��N2��H2��N2��3H2 2NH3 2NH3 | ������Ũ�� | ���ԸߵĴ��� | ����һ��Ĵ��� |
| D | 2 mol SO2��1 mol O2����ͬ�¶��·�����Ӧ��2SO2��O2 2SO3 2SO3 | SO3�����ʵ��� | 2������ѹ | 10������ѹ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ij�ܱ������У����淴Ӧ��A(g)��B(g) xC(g)����ͼ��(��)��ʾ��ϵ���ɴ��ƶϣ���ͼ��(��)�IJ���ȷ��˵����(����)
xC(g)����ͼ��(��)��ʾ��ϵ���ɴ��ƶϣ���ͼ��(��)�IJ���ȷ��˵����(����)
| A��p3>p4��y���ʾA��ת���� |
| B��p3>p4��y���ʾB���������� |
| C��p3>p4��y���ʾC���������� |
| D��p3>p4��y���ʾ��������ƽ����Է������� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com