
【题目】对于反应C(s)+H2O(g) ![]() CO(g)+H2(g) ;ΔH >0,下列有关说法正确的是
CO(g)+H2(g) ;ΔH >0,下列有关说法正确的是
A.平衡常数表达式为 ![]()
B.增大体系压强,平衡常数K不发生变化
C.升高体系温度,平衡常数K减小
D.增加C(s)的量,平衡正向移动
【答案】B
【解析】A、平衡常数表达式中固体和纯液体不代入表达式中,A不符合题意;
B、平衡常数是温度的函数,温度不变常数不变,B符合题意;
C、平衡常数是温度的函数,正反应是吸热反应,温度升高,K值增大,C不符合题意;
D、增加C(s)的量的改变,平衡不移动,D不符合题意;
所以答案是:B
【考点精析】掌握化学平衡常数的含义和化学平衡移动原理以及影响因素是解答本题的根本,需要知道指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度不变的状态;影响因素:①浓度:增大反应物(或减小生成物)浓度,平衡向正反应方向移动;②压强:增大压强平衡向气体体积减小的方向移动.减小压强平衡向气体体积增大的方向移动;③温度:升高温度,平衡向吸热反应方向移动.降低温度,平衡向放热反应方向移动;④催化剂:不能影响平衡移动.


科目:高中化学 来源: 题型:
【题目】碘及其化合物在生产、生活和科技等方面都有着重要的应用。回答下列问题:
(1)已知:①2I2(s)+5O2(g)=2I2O5(s) ΔH=—1966 kJmol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=—1200 kJmol-1 。
则5CO(g)+I2O5(s)=5CO2(g)+I2(s)的△H= __________________________。
(2)碘不易溶于水,但易溶于碘化钾溶液并生成多碘离子,反应如下:
① I2(s)+I-(aq)![]() I3-(aq) △H<0; ② I2 (s)+2I-(aq)
I3-(aq) △H<0; ② I2 (s)+2I-(aq)![]() I42-(aq)。
I42-(aq)。
温度降低时,反应①的平衡常数将______________(填“增大”“减小”或“不变”);反应②的平衡常数的表达式为K=__________________________。
(3)碘与钨在一定温度下,可发生如下可逆反应:W(s)+I2(g)![]() WI2(g)。现准确称取0.508g碘和0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应。如图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
WI2(g)。现准确称取0.508g碘和0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应。如图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
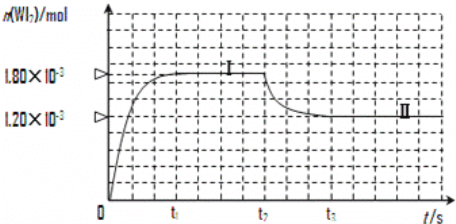
① 该反应△H____________0(填“>”或“<”)。
② 反应从开始到t1(t1= 3 min)时间内 I2 的平均反应速率v(I2)=_________。
③ 在450℃时,该反应的平衡常数K的值为__________________。
④ 能够说明上述反应已经达到平衡状态的有________________ (填选项字母)。
A.I2与WI2的浓度相等 B. 容器内各气体的浓度不再改变
C. 容器内混合气体的密度不再改变 D.容器内气体压强不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 离子晶体不一定都含有金属元素
B. 离子晶体中除含离子键外,还可能含有其他化学键
C. 金属元素与非金属元素构成的晶体不一定是离子晶体
D. 熔化后能导电的晶体一定是离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10(g)C8H8(g)+H2(g)△H=120kJ·mol-1某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是。
(2)该温度下,该反应的化学平衡常数是。
(3)若保持其他条件不变,用0.40 mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是。此时,该合成反应是否达到了平衡状态?(填“是”或“否”)。
(4)工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示。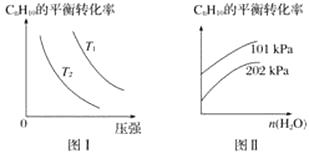
①由图Ⅰ可知,T1T2(填“大于”、“小于”或“等于”)。
②由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将(填“越大”、“越小”或“不变”),原因是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同周期的两种主族元素A和B能够形成离子化合物AmBn , 已知A的原子序数为a,则B的原子序数可能为( )
A.a+8+m﹣n
B.a+16﹣m+n
C.a+24﹣m﹣n
D.a+18﹣m﹣n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、钠混合物投入足量的水中,充分反应后,得到澄清溶液,并收集到4.48L氢气(标准状况),若钠的物质的量为0.1mol,则铝的物质的量为
A.0.2molB.0.1molC.0.05molD.0.025mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.国产C919大型客机的正式下线,标志着我国航空工业进入了新的发展阶段,我国成为世界上少数几个具有自行研制大型飞机的国家之一。
(1)飞机的外壳通常采用镁一铝合金材料,铝的价电子排布图为_______________,第一电离能:铝________(填“大于”或“小于”)镁。
(2)为了减轻质量而不减轻外壳承压能力,现代飞机通常采用复合材料一玻璃纤维增强塑料,其成分之一为环氧树脂,常见的E51型环氧树脂中部分结构如图甲所示,其中碳原子的杂化方式为___________,该材料此部分中所含元素的电负性从小到大的顺序为_______________。

II.大型飞机的发动机在制造过程中通常采用碳化钨做关键部位的材料。
(1)钨元素位于周期表的第六周期第VIB族,请写出其位于同一族的元素铬的原子的价电子排布式__________________,
(2)图乙为碳化钨晶体的一部分结构,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙+固溶体,也称为填隙化合物。在此结构中,其中钨原子有_______个,1个钨原子周围距离钨原子最近的碳原子有_______个,下列金属元素的堆积方式与碳化钨晶胞中碳原子和钨原子所处位置类似的是___________(填序号)。
A.Fe Cu B.Ti Au C.Mg Zn D.Cu Ag
(4)设该部分晶体的体积为Vcm3,碳化钨的摩尔质量为M g/mol,密度为b g/cm3,则阿伏加德罗常数NA用上述数据可以表示为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分子中既有σ键又有π键的是( )
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2
A. ①②③ B. ③④⑤⑥
C. ①③⑤ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有下列电子排布式的原子中,不能形成π键的是( )
A. 1s22s22p63s23p4 B. 1s22s22p3
C. 1s22s22p63s1 D. 1s22s22p2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com