
【题目】同周期的两种主族元素A和B能够形成离子化合物AmBn , 已知A的原子序数为a,则B的原子序数可能为( )
A.a+8+m﹣n
B.a+16﹣m+n
C.a+24﹣m﹣n
D.a+18﹣m﹣n
科目:高中化学 来源: 题型:
【题目】如表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
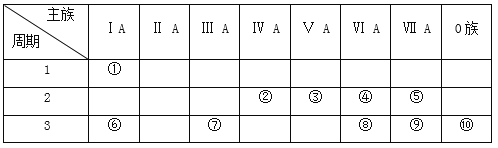
(1)在上述元素最高价氧化物对应水化物中,酸性最强的是_______________,碱性最强的是_____________,显两性的是_____________。(化学式)
(2)这些元素中,化学性质最不活泼原子的原子结构示意图为__________;气态氢化物中,最稳定的是_________(化学式),②③④⑤形成的氢化物中沸点最高的是_______(化学式)。
(3)①和④两种元素的原子按1:1组成的常见化合物的电子式为_____________。
(4)④、⑥、⑦、⑨的简单离子半径由大到小的顺序为______________________________(用离子符号和“>”表示)。
(5)⑥和⑦的最高价氧化物对应水化物之间发生反应的化学方程式_____________________。
(6)为了证明⑥和⑦两种元素的金属性强弱,下列说法或实验能提供证据的是_______。
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期。Y和M位于同主族,Y原子最外层电子数是电子层数的3倍。这五种元素组成一种离子化合物Q,取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生的沉定与氢氧化钠溶液体积的关系如图所示。下列说法不正确的是
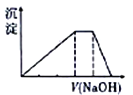
A. 气态氢化物的沸点:Y>X
B. R与除Z以外的其他3种元素均能形成共价化合物
C. 简单离子的半径:M>Y>Z
D. Y与其他4种元素均可形成至少两种二元化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应C(s)+H2O(g) ![]() CO(g)+H2(g) ;ΔH >0,下列有关说法正确的是
CO(g)+H2(g) ;ΔH >0,下列有关说法正确的是
A.平衡常数表达式为 ![]()
B.增大体系压强,平衡常数K不发生变化
C.升高体系温度,平衡常数K减小
D.增加C(s)的量,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)已知某反应中能量变化如图所示,所得结论错误的是( )
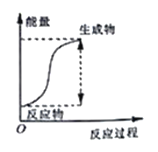
A. 该图像可以表示氯化铵与消石灰反应的能量变化
B. 该反应过程中,一定有其他形式的能量转化成化学能
C. 该反应过程中,形成新化学键释放的总能量小于断裂旧化学键吸收的总能量
D. 因为生成物的总能量高于反应物的总能量,所以该反应一定需要加热才可进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们常常利用化学反应中的能量变化为人类服务。
(1)氢能是一种具有发展前景的理想清洁能源,氢气燃烧时放出大最的热。氢气燃烧生成水蒸气的能最变化如下图所示:

根据上图可知,在化学反应中,不仅存在物质的变化,而且伴随着______变化,1molH2完全燃烧生成1molH2O(气态)时,释放的能量是_______kJ。
(2)下列化学反应在理论上可以设计成原电池的是________。
A.Fe+2FeCl3=3FeCl2 B.SO3+H2O=H2SO4
C.CH4+2O2![]() CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
(3)下图是某兴趣小组设计的原电池示意图,实验结束后,在实验报告上记录信息如下:

a.电流计指针偏转 |
b.Cu极有H2产生 |
c.H+向负极移动 |
d.电流由Zn经导线流向Cu |
①实验报告中记录合理的是_______(填序号)。
②请写出该电池的负极反应式_________。
③若有1mol电子流过导线,则理论上产生H2的质量为______g.
④将稀H2SO4换成CuSO4溶液,电极质量增加的是______(填“锌极”或“铜极”,下同),溶液中SO42-移向_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆 AB 两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠 杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓 CuSO4 溶液,一段时间后,下列 有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)
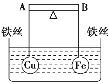
A. 杠杆为导体和绝缘体时,均为 A 端高 B 端低
B. 杠杆为导体和绝缘体时,均为 A 端低 B 端高
C. 当杠杆为绝缘体时,A 端低 B 端高;为导体时,A 端高 B 端低
D. 当杠杆为绝缘体时,A 端高 B 端低;为导体时,A 端低 B 端高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com