
【题目】人们常常利用化学反应中的能量变化为人类服务。
(1)氢能是一种具有发展前景的理想清洁能源,氢气燃烧时放出大最的热。氢气燃烧生成水蒸气的能最变化如下图所示:

根据上图可知,在化学反应中,不仅存在物质的变化,而且伴随着______变化,1molH2完全燃烧生成1molH2O(气态)时,释放的能量是_______kJ。
(2)下列化学反应在理论上可以设计成原电池的是________。
A.Fe+2FeCl3=3FeCl2 B.SO3+H2O=H2SO4
C.CH4+2O2![]() CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
(3)下图是某兴趣小组设计的原电池示意图,实验结束后,在实验报告上记录信息如下:

a.电流计指针偏转 |
b.Cu极有H2产生 |
c.H+向负极移动 |
d.电流由Zn经导线流向Cu |
①实验报告中记录合理的是_______(填序号)。
②请写出该电池的负极反应式_________。
③若有1mol电子流过导线,则理论上产生H2的质量为______g.
④将稀H2SO4换成CuSO4溶液,电极质量增加的是______(填“锌极”或“铜极”,下同),溶液中SO42-移向_______。
【答案】 能量 245 AC ab Zn- 2e-= Zn2+ 1 铜极 锌极
【解析】(1) 根据上图可知,在化学反应中,不仅存在物质的变化,而且伴随着能量变化,1molH2完全燃烧生成1molH2O(气态)时,释放的能量是930 kJ-436 kJ-249 kJ =245kJ;(2)能设计成原电池的反应通常是放热反应,且必须是能自发进行的氧化还原反应,A.Fe+2FeCl3=3FeCl2是自发进行的氧化还原反应,能设计成原电池,故选;B.SO3+H2O=H2SO4不是氧化还原反应,所以不能设计成原电池,故不选;C、CH4+2O2![]() CO2+2H2O是放热反应且能自发的进行氧化还原反应,所以能设计成原电池,故选;D、Ba(OH)2+H2SO4=BaSO4+2H2O不是氧化还原反应,所以不能设计成原电池,故不选;答案选AC;(3) ①在该原电池中,Zn比Cu活泼,故Zn作负极,Cu作正极,a.电流计指针偏转,故正确;b. Cu作正极,正极反应为2H++2e-=H2↑,故正确;c.H+向正极移动,故错误;d.电子由Zn流出经导线流向Cu,电流由Cu经导线流向Zn,故错误;实验报告中记录合理的是ab;②负极反应为Zn-2e-=Zn2+;③若有1mol电子流过导线,则理论上产生产生0.5 mol H2,H2的质量为1g;④将稀H2SO4换成CuSO4溶液,正极铜电极上析出铜,质量增加的是铜极;在溶液中SO42-向负极锌极移动。
CO2+2H2O是放热反应且能自发的进行氧化还原反应,所以能设计成原电池,故选;D、Ba(OH)2+H2SO4=BaSO4+2H2O不是氧化还原反应,所以不能设计成原电池,故不选;答案选AC;(3) ①在该原电池中,Zn比Cu活泼,故Zn作负极,Cu作正极,a.电流计指针偏转,故正确;b. Cu作正极,正极反应为2H++2e-=H2↑,故正确;c.H+向正极移动,故错误;d.电子由Zn流出经导线流向Cu,电流由Cu经导线流向Zn,故错误;实验报告中记录合理的是ab;②负极反应为Zn-2e-=Zn2+;③若有1mol电子流过导线,则理论上产生产生0.5 mol H2,H2的质量为1g;④将稀H2SO4换成CuSO4溶液,正极铜电极上析出铜,质量增加的是铜极;在溶液中SO42-向负极锌极移动。


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)![]() NH2COONH4(s)。该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
NH2COONH4(s)。该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
(1)该反应在一定条件下能够自发进行,则反应的ΔH________0。(填大于、小于或等于)
(2)写出生成碳酸氢铵的化学方程式________。
(3)实验步骤如下:
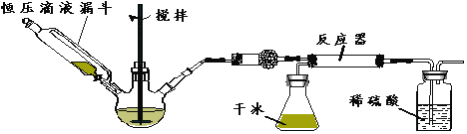
步骤1:按图所示组装仪器,检查装置气密性。
步骤2:在相应仪器中装入药品,其中在三颈烧瓶中加入氢氧化钠固体,恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品
……
①干燥管中盛放的药品是_________。
②对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点有______,_______。
③以恒压滴液漏斗代替分液漏斗的目的是________________。
④反应后期CO2气流量下降时,可采取的相应措施是______________。
(4)该实验装置中可能存在的缺陷是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同周期的两种主族元素A和B能够形成离子化合物AmBn , 已知A的原子序数为a,则B的原子序数可能为( )
A.a+8+m﹣n
B.a+16﹣m+n
C.a+24﹣m﹣n
D.a+18﹣m﹣n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.国产C919大型客机的正式下线,标志着我国航空工业进入了新的发展阶段,我国成为世界上少数几个具有自行研制大型飞机的国家之一。
(1)飞机的外壳通常采用镁一铝合金材料,铝的价电子排布图为_______________,第一电离能:铝________(填“大于”或“小于”)镁。
(2)为了减轻质量而不减轻外壳承压能力,现代飞机通常采用复合材料一玻璃纤维增强塑料,其成分之一为环氧树脂,常见的E51型环氧树脂中部分结构如图甲所示,其中碳原子的杂化方式为___________,该材料此部分中所含元素的电负性从小到大的顺序为_______________。

II.大型飞机的发动机在制造过程中通常采用碳化钨做关键部位的材料。
(1)钨元素位于周期表的第六周期第VIB族,请写出其位于同一族的元素铬的原子的价电子排布式__________________,
(2)图乙为碳化钨晶体的一部分结构,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙+固溶体,也称为填隙化合物。在此结构中,其中钨原子有_______个,1个钨原子周围距离钨原子最近的碳原子有_______个,下列金属元素的堆积方式与碳化钨晶胞中碳原子和钨原子所处位置类似的是___________(填序号)。
A.Fe Cu B.Ti Au C.Mg Zn D.Cu Ag
(4)设该部分晶体的体积为Vcm3,碳化钨的摩尔质量为M g/mol,密度为b g/cm3,则阿伏加德罗常数NA用上述数据可以表示为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M均为短周期元素,它们在周期表中的位置如下图。若Y原子的最外层电子数是次外层电子数的3倍。下列说法中正确的是
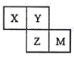
A. 原子半径:X<Y<Z<M
B. 最简单气态氢化物的热稳定性:Y<Z
C. 最高价氧化物对应水化物的酸性:Z<M
D. X与Y形成的化合物均易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分子中既有σ键又有π键的是( )
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2
A. ①②③ B. ③④⑤⑥
C. ①③⑤ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应的快慢和限度对人类生产、生活有重要的意义。
(1)将影响化学反应速率的因素镇在空格处。
实例 | 影响因素 |
食物放在冰箱里延长保质期 | ①___ |
实验室将块状药品研细,再进行反应 | ②___ |
(2)某小组将酸性KMnO4溶液与H2C2O4(具有还原性)溶液混合,用反应中溶液紫色消失快慢的方法研究形响化学反应速率的因素。实验中酸性KMnO4溶液(0.0010mol/L)、H2C2O4溶液的用量均为4mL(忽略加入固体,溶液混合时体积的变化)。
①该反应中氧化剂与还原剂的物质的量之比为________。
②请帮助他们完成以下实验设计表:填写IV中的数据,并将实验目的补充完整。
实验编号 | 温度/K | 催化剂的用量/g | H2C2O4溶液的浓度/mol.L-1 | 实验目的 |
I | 298 | 0.5 | 0.010 | A.实验I和II探究____对反应速率的影响 B.实验I和III探究____对反应速率的影响 C.实验I和IV探究催化剂对反应速率的影响 |
II | 298 | 0.5 | 0.050 | |
III | 323 | 0.5 | 0.010 | |
IV | ____ | ____ | ____ |
③该小组同学对实验II进行了3次实验,测得以下数据:
实验编号 | 溶液退色所需时问t/min | ||
第1次 | 第2次 | 第3次 | |
II | 4.9 | 5.1 | 5.0 |
实验II中用KMnO4表示该反应的平均反应速率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】垃圾假单胞菌株能够在分解有机物的同时分泌物质产生电能,其原理如下图所示。下列说法正确的是( )

A. 电流由左侧电极经过负载后流向右侧电极
B. 放电过程中,正极附近pH 变小
C. 若1molO2 参与电极反应,有4 mol H+穿过质子交换膜进入右室
D. 负极电极反应为:H2PCA + 2e-=PCA + 2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可用于合成除草剂、杀草丹等农药。可通过H2S与CO2在高温下反应制得COS:H2S(g)+CO2(g) ![]() COS(g) +H2O(g) △H > 0。在2 L容器中充入一定量的H2S和CO2发生上述反应,数据如下:
COS(g) +H2O(g) △H > 0。在2 L容器中充入一定量的H2S和CO2发生上述反应,数据如下:
实验 | 温度/℃ | 起始时 | 平衡时 | 平衡 常数 | |||
n(CO2)/mol | n(H2S)/mol | n(COS)/mol | n(H2O)/mol | n(COS)/mol | |||
1 | T1 | 0.200 | 0.200 | 0 | 0 | 0.0200 | K1 |
2 | T2 | 0.200 | 0.200 | 0 | 0 | n2 | K2 =1/36 |
3 | T2 | 0.400 | 0.400 | 0 | 0 | n3 | K3 |
下列判断不正确的是
A. K1=1/81
B. K2 = K3且n3= 2n2
C. 初始反应速率:实验3 gt; 实验2 > 实验1
D. 实验2中平衡时的c(COS)约为0.0286 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com