
【题目】在短周期元素中,原子最外电子层只有1个或2个电子的元素( )
A.是非金属元素
B.是稀有气体元素
C.是金属元素
D.无法确认为哪一类元素
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】砷(As)及其化合物在生产、医疗、科技等方面有许多应用
(1)中国自古“信口雌黄”、“雄黄入药”之说。雄黄As2S3和雌黄As4S4都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。一定条件下,雌黄和雄黄的转化关系如图所示。
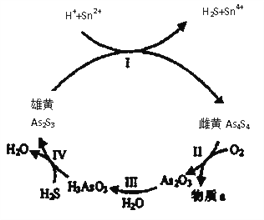
①雌黄和雄黄中S元素均为-2,I中发生的离子方程式是__________。
②Ⅱ中,雌黄在空气中加热至300℃时会产生两种物质,若4.28g As4S4反应转移0.28mole-,则a为__________(填化学式);砒霜(As2O3)可水将氧化成H3AsO4而除去,该反应的化学方程式为:__________。
(2)AsH3是一种很强的还原剂,室温下, 0.4mol AsH3气体在空气中自燃,氧化产物为As2O3固体,放出b kJ 热量,AsH3自燃的热化学方程式是:__________。
(3)将Na3AsO3(aq)+I2(aq)+H2O(l)![]() Na2HAsO4(aq)+NaI (aq)设计成原电池如图所示,放电时电流强度(I)与时间关系如图所示.
Na2HAsO4(aq)+NaI (aq)设计成原电池如图所示,放电时电流强度(I)与时间关系如图所示.
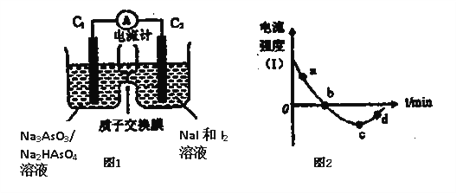
①如图中表示在该时刻上述可逆反应达到平衡状态的点是__________(填字母)。
②已知:a点对应如图中电流由C1极经外电路流向C2极。则d点对应的负极的反应式为__________。
③如图中,b→c改变条件可能是__________(填代号)。
A.向左室中加入适量的浓Na3AsO3溶液 B.向左室中加入适量的烧碱溶液
C.向右室中加入适量的浓KI溶液 D. 向右室中加入适量的稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取含Cr2O72-的模拟水样若干份,在不同pH条件下,分别向每个水样中加一定量的FeSO4或NaHSO3固体,充分反应后再滴加碱液生成Cr(OH)3沉淀,从而测定除铬率,实验结果如图所示。下列说法正确的是
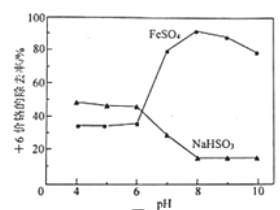
A. 理论上FeSO4的除铬率比等质量的NaHSO3高
B. 用NaHSO3除铬时,pH越低,越有利于提高除铬率
C. pH>8,FeSO4的除铬率下降与废水中溶解氧参与反应有关
D. 从提高除铬率的角度分析,处理酸性含铬废水应选用NaHSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)==2NO(g) △H =+180.5kJ·mol-1
C(s)+O2(g)=CO2(g) △H =-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H =-221kJ·mol-1
若某反应的平衡常数表达式为:k=[c(N2)·c2(CO2)]/[c2(NO)·c(CO)],请写出此反应的热化学方程式_______。
(2)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g),某温度下测得恒容密闭容器中N2O5浓度随时间的变化如表:
4NO2(g)+O2(g),某温度下测得恒容密闭容器中N2O5浓度随时间的变化如表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
C(N2O6)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为P0,第3.00 min时体系压强为P1,则P1:P0=_______;2min~5.00min 内,O2 的 平 均反应速率为_____________。
②一定温度下,在恒容密闭容器中充人一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是___。
a.NO2 和O2 的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)= v逆(N2 O5 ) d.气体的平均相对分子质量为43.2,且保持不变
(3)将2molN2 和4mo1H2 置于lL的恒容密闭容器中反应。测得不同温度、不同时间段内合成NH3 反应中N2 的转化率,得到数据如下表:

表中a、b、25%三者由大到小的顺序为_____,理由是_____。
(4)将(3)中实验得到的混合气体通入醋酸溶液中并恢复到25℃,当两者恰好反应时,生成的CH3COONH4溶液呈中性,则25℃时NH3·H2O的电离平衡常数Kb=______(已知:25℃时0.18mol/LCH3COOH 溶液中c(H+)=1.8×10-3mol/L)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B3N3H6与C6H6是等电子体,则下列说法不正确的是( )
A. B3N3H6能发生加成反应和取代反应 B. B3N3H6具有碱性
C. B3N3H6各原子在同一平面上 D. B3N3H6不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在生产、生活和科技等方面都有着重要的应用。回答下列问题:
(1)已知:①2I2(s)+5O2(g)=2I2O5(s) ΔH=—1966 kJmol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=—1200 kJmol-1 。
则5CO(g)+I2O5(s)=5CO2(g)+I2(s)的△H= __________________________。
(2)碘不易溶于水,但易溶于碘化钾溶液并生成多碘离子,反应如下:
① I2(s)+I-(aq)![]() I3-(aq) △H<0; ② I2 (s)+2I-(aq)
I3-(aq) △H<0; ② I2 (s)+2I-(aq)![]() I42-(aq)。
I42-(aq)。
温度降低时,反应①的平衡常数将______________(填“增大”“减小”或“不变”);反应②的平衡常数的表达式为K=__________________________。
(3)碘与钨在一定温度下,可发生如下可逆反应:W(s)+I2(g)![]() WI2(g)。现准确称取0.508g碘和0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应。如图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
WI2(g)。现准确称取0.508g碘和0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应。如图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
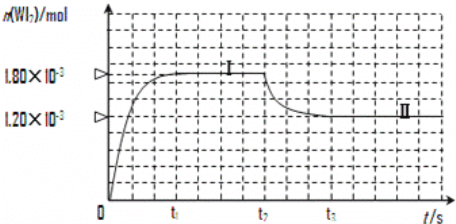
① 该反应△H____________0(填“>”或“<”)。
② 反应从开始到t1(t1= 3 min)时间内 I2 的平均反应速率v(I2)=_________。
③ 在450℃时,该反应的平衡常数K的值为__________________。
④ 能够说明上述反应已经达到平衡状态的有________________ (填选项字母)。
A.I2与WI2的浓度相等 B. 容器内各气体的浓度不再改变
C. 容器内混合气体的密度不再改变 D.容器内气体压强不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素X、Y、Z、M、W的原子序数与其常见化合价的关系如图所示,下列关系不正确的是( )
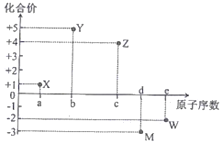
A. 元素X可能为锂
B. 原子半径大小:r(M)>r(w)
C. X2W中各原子均达8电子稳定结构
D. 元素气态氢化物的沸点:YH3>MH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)![]() NH2COONH4(s)。该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
NH2COONH4(s)。该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
(1)该反应在一定条件下能够自发进行,则反应的ΔH________0。(填大于、小于或等于)
(2)写出生成碳酸氢铵的化学方程式________。
(3)实验步骤如下:
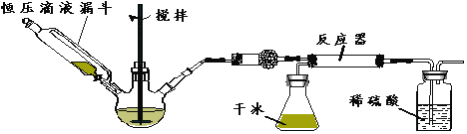
步骤1:按图所示组装仪器,检查装置气密性。
步骤2:在相应仪器中装入药品,其中在三颈烧瓶中加入氢氧化钠固体,恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品
……
①干燥管中盛放的药品是_________。
②对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点有______,_______。
③以恒压滴液漏斗代替分液漏斗的目的是________________。
④反应后期CO2气流量下降时,可采取的相应措施是______________。
(4)该实验装置中可能存在的缺陷是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同周期的两种主族元素A和B能够形成离子化合物AmBn , 已知A的原子序数为a,则B的原子序数可能为( )
A.a+8+m﹣n
B.a+16﹣m+n
C.a+24﹣m﹣n
D.a+18﹣m﹣n
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com