
分析 (1)该反应中Fe元素化合价由+2价变为+3价、Cr元素化合价由+6价变为+3价,根据转移电子守恒计算消耗绿矾物质的量;
(2)每消耗0.1mol Na2S2O3转移0.8mol e-,根据电子转移守恒,可知S2O32-被氧化生成SO42-,而Cr2O72-离子被还原为Cr3+离子,配平书写离子方程式;
(3)根据Ksp[Cr(OH)3]=c(Cr3+)•(OH-)3,来计算铬离子的浓度是否小于10-5mol/L;
(4)Fe作电极电解Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液的pH升高,产生Cr(OH)3沉淀除去,则应该用Fe作阳极;
(5)溶液中氢离子在阴极放电生成氢气,导致阴极附近氢离子浓度降低;亚铁离子被氧化生成Fe3+,Fe3+和OH-反应生成Fe(OH)3沉淀;
(6)持电流强度为0.5A,电池工作五分钟,则电量为0.5A×300s=150C,转移电子的物质的量=$\frac{150C}{96500C/mol}$,Cr元素化合价由+6价变为+3价,据此计算.
解答 解:(1)该反应中Fe元素化合价由+2价变为+3价、Cr元素化合价由+6价变为+3价,根据转移电子守恒计算消耗n(FeSO4•7H2O)=$\frac{1mol×2×(6-3)}{3-2}$=6mol,故答案为:6;
(2)每消耗0.1mol Na2S2O3转移0.8mol e-,根据电子转移守恒,可知S2O32-被氧化生成SO42-,而Cr2O72-离子被还原为Cr3+离子,配平可得离子方程式为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
(3)pH=5时,(OH-)=10-9mol/L,所以c(Cr3+)•(10-9)3=6.3×10-31,解之得c(Cr3+)=6.3×10-4>10-5,所以没有沉淀完全,故答案为:c(Cr3+)•(10-9)3=6.3×10-31,解之得c(Cr3+)=6.3×10-4>10-5;
(4)Fe作电极电解Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液的pH升高,产生Cr(OH)3沉淀除去,则应该用Fe作阳极,阳极上Fe失电子生成亚铁离子,电极反应式为Fe-2e-=Fe2+,
故答案为:Fe-2e-=Fe2+;
(5)溶液中氢离子在阴极放电生成氢气,导致阴极附近氢离子浓度降低,溶液的pH升高,电极反应式为2H++2e-=H2 ↑;亚铁离子被氧化生成Fe3+,Fe3+和OH-反应生成Fe(OH)3沉淀,
故答案为:2H++2e-=H2 ↑;Fe(OH)3;
(6)持电流强度为0.5A,电池工作五分钟,则电量为0.5A×300s=150C,转移电子的物质的量=$\frac{150C}{96500C/mol}$,Cr元素化合价由+6价变为+3价,则理论上除去n(Na2Cr2O7)=$\frac{\frac{150C}{96500C/mol}}{2×3}$-0.0003mol,
故答案为:0.0003.
点评 本题考查氧化还原反应计算、电解原理、物质分离和提纯等知识点,为高频考点,侧重考查学生分析计算能力,明确氧化还原反应中转移电子守恒是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
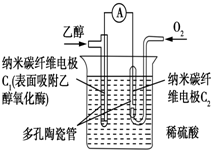
| A. | C1极为电池负极,C2极为电池正极 | |
| B. | 溶液中的H+向C1电极移动 | |
| C. | 该生物燃料电池的总反应方程式为C2H5OH+3O2═2CO2+3H2O | |
| D. | 电流由C2极经外电路流向C1极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向10mL浓度为0.1mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中水的电离程度始终增大 | |
| B. | 0.01mol•L-1CH3COOH溶液中水的电离程度小于0.01mol•L-1盐酸中水的电离程度 | |
| C. | 将0.01mol•L-1盐酸与pH=12的氨水等体积混合,所得溶液中由水电离出的c(OH-)<1×10-7mol•L-1 | |
| D. | 将0.01mol•L-1的CH3COOH溶液与pH=12的氨水等体积混合,所得溶液中由水电离出的c(OH-)>1×10-7mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
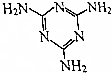 三聚氰胺的结构式如图所示,尿素[CO(NH2)2]在一定条件下发生分解反应可制得三聚氰胺和CO2等物质,下列说法不正确的是( )
三聚氰胺的结构式如图所示,尿素[CO(NH2)2]在一定条件下发生分解反应可制得三聚氰胺和CO2等物质,下列说法不正确的是( )| A. | 三聚氰胺的分子式为C3H6N6 | |
| B. | 氰胺的结构简式为H2N-C≡N | |
| C. | 尿素分解制三聚氰胺时,除生成CO2外,还会生成NH3 | |
| D. | 三聚氰胺属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和氯水中滴加0.1mol/L的NaOH溶液:c(H+)+c(Na+ )=2c(ClO-)+c(HClO)+c(OH-) | |
| B. | 向20mL 0.2mol/L 的H2S溶液中逐滴加入0.2mol/L的NaOH溶液30mL,溶液中存在以下关系:c(S2-)+2c(OH-)=c(HS-)+2c(H+)+2c(H2S) | |
| C. | pH相同的①CH3COONa②NaClO 二种溶液的c(Na+):①>② | |
| D. | 常温下,向20mL 0.1mol/L的CH3COONa溶液中逐滴加入0.1mol/L盐酸溶液的pH=7时,c(CH3COOH)=c(Cl-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  设计铜锌原电池 | B. |  制备氢氧化亚铁并观察其颜色 | ||
| C. | 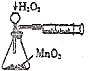 定量测定H2O2的分解速率 | D. | 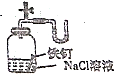 证明铁生锈与空气有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2g | B. | 3g | C. | 3.5g | D. | 4.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
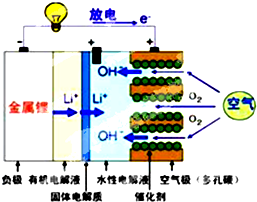 美国IBM公司设计出了一款新型锂空气电池,其原理就是通过吸入空气与设备内的锂离子发生反应,进行能量的提供.因其独特的放电方式,也称呼吸式电池.负极采用金属锂条,负极的电解液采用含有锂盐的有机电解液.中间设有用于隔开正极和负极的锂离子固体电解质.正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合.如图所示.下列说法不正确的是( )
美国IBM公司设计出了一款新型锂空气电池,其原理就是通过吸入空气与设备内的锂离子发生反应,进行能量的提供.因其独特的放电方式,也称呼吸式电池.负极采用金属锂条,负极的电解液采用含有锂盐的有机电解液.中间设有用于隔开正极和负极的锂离子固体电解质.正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合.如图所示.下列说法不正确的是( )| A. | 负极反应:Li-e-=Li+,金属锂以锂离子(Li+)的形 式溶于有机电解液,电子供应给导线.溶解的锂离子(Li+)穿过固体电解质移到正极的水性电解液中 | |
| B. | 正极反应:O2+2H2O+4e-=4OH-,在正极的水性电解液中与锂离子(Li+)结合生成水溶性氢氧化锂(LiOH),并能实现锂元素的循环 | |
| C. | 在负极的有机电解液和空气极的水性电解液之间,用只能通过锂离子的固体电解质隔开,以防止两电解液发生混合,而且能促进电池发生反应 | |
| D. | 锂-空气电池至今都未普及,原因是它存在致命缺陷,即固体反应生成物氧化锂(Li2O)在正极堆积,使电解液与空气的接触被阻断,从而导致放电停止 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com