
下列各组性质比较中,正确的是()
①酸性:HClO4>HBrO4>HIO4
②离子还原性:S2﹣>Cl﹣>Br﹣>I﹣
③沸点:HF>HCl>HBr>HI
④金属性:K>Na>Mg>Al
⑤气态氢化物稳定性:HF>HCl>H2S
⑥半径:O2﹣>Na+>Na>Cl.
A. ①②③ B. ②③④ C. ①④⑤ D. ①②③④⑤⑥
考点: 非金属在元素周期表中的位置及其性质递变的规律;金属在元素周期表中的位置及其性质递变的规律.
专题: 元素周期律与元素周期表专题.
分析: ①元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强
②元素的非金属性越强,对应离子还原性越弱;
③分子的性对分子质量越大,沸点越高,含有氢键的物质最高;
④根据元素周期律确定金属的活泼性;
⑤元素的非金属性越强,气态氢化物稳定性越强;
⑥电子层越多,半径越大,电子层一样,核电荷数越多,半径越小.
解答: 解:①非金属性Cl>Br>I,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,即酸性:HClO4>HBrO4>HIO4,故正确;
②元素的非金属性Cl>Br>I>S,对应离子还原性S2﹣>I﹣>Br﹣>Cl﹣,故错误;
③沸点:HF>HI>HBr>HCl,故错误;
④同主族行上到下,金属性增强:K>Na,同周期,从左到右金属性减弱,即Na>Mg>Al,即金属性:K>Na>Mg>Al,故正确;
⑤元素的非金属性F>Cl>S,气态氢化物稳定性HF>HCl>H2S,故正确;
⑥电子层越多,半径越大,所以Na、Cl的大于钠离子和氧离子的半径,电子层一样,核电荷数越多,半径越小,Na>Cl,O2﹣>Na+,即Na>Cl>O2﹣>Na+,故错误.
故选C.
点评: 本题考查较为综合,涉及元素非金属性、非金属性、沸点,微粒半径大小、氢化物稳定性等知识,侧重于学生的分析能力的考查,注意把握元素周期律的递变规律,难度中等,学习中注意积累.


科目:高中化学 来源: 题型:
对于同一周期从左到右的主族元素,下列说法中,正确的是()
A. 原子半径逐渐增大 B. 原子的得电子能力逐渐减弱
C. 最高正化合价逐渐减小 D. 元素的金属性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
用98%的浓硫酸(密度为1.84g/cm3)配制100mL 1 mol/L的稀硫酸.现给出下列仪器(配制过程中可能用到):①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,按使用仪器的先后顺序排列正确的是()
A. ④③⑦⑤⑥ B. ②⑤⑦⑥ C. ①③⑤⑥⑦ D. ②⑥③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应N2(g)+3H2(g)⇌2NH3(g)达到平衡状态,下列说法中正确的是()
A. 该反应停止,N2和H2不再化合
B. N2、H2、NH3浓度不变
C. N2、H2、NH3浓度相等
D. N2、H2、NH3的物质的量之比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
电池是人类生产和生活中重要的能量来源.各式各样电池的发明是化学对人类的一项重大贡献.下列有关电池的叙述正确的是()
A. 锌锰干电池工作一段时间后碳棒变细
B. 氢氧燃料电池可将热能直接转变为电能
C. 氢氧燃料电池工作时氢气在负极被氧化
D. 太阳能电池的主要材料是高纯度的二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某元素的阳离子R2+的核内中子数为n,质量数为A,则mg它的氧化物中所含电子的物质的量是()
A. 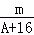 (A﹣n+8)mol B.
(A﹣n+8)mol B. 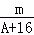 (A﹣n+10)mol
(A﹣n+10)mol
C. (A﹣n+2)mol D. 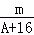 (A﹣n+6)mol
(A﹣n+6)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在强碱性溶液中能大量共存的离子组是()
A. Na+、NH4+、H+、NO3﹣ B. K+、Ca2+、HCO3﹣、NO3﹣
C. Na+、Mg2+、Cl﹣、NO3﹣ D. Na+、Ba2+、NO3﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
汞使用的历史很悠久,用途很广泛.在元素周期表中,汞元素的信息如图所示,对图中信息解释正确的是( )

|
| A. | 汞属于金属元素 | B. | 汞原子核外电子数是200.6 |
|
| C. | 汞原子核内中子数是80 | D. | 汞原子的相对原子质量是80 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com